| Общая информация » Каталог студенческих работ » ЕСТЕСТВЕННЫЕ ДИСЦИПЛИНЫ » Химия |
| 25.09.2014, 16:15 | ||||||||||||||||||||||||||||||
Каждый студент в течение межсессионного периода (семестра) выполняет две письменные контрольные работы. Вариант заданий по этим контрольным работам соответствует двум последним цифрам студенческого билета. Например, если номер студенческого билета 73842, то ему соответствует вариант № 42. Варианты для первой контрольной работы и соответствующие им задания представлены в конце данного пособия. Контрольная работа № 1. ЗАДАЧИ 1. Определите количество вещества эквивалента и молярную массу эквивалентов фосфора, кислорода и брома в соединениях PH3, H2O, HBr. 2. В какой массе NaOH содержится то же количество эквивалентов, что и в 140 г KOH. Ответ: 100 г. 3. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите молярную массу эквивалента этого металла. Ответ: 32,5 г/моль. 4. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите молярную массу эквивалента этого металла. Ответ: 9 г/моль. 5. Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите молярную массу эквивалента, молярную и атомную массы этого элемента. 6. Чему равен при н.у. эквивалентный объем водорода? Вычислите молярную массу эквивалента металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н.у.). Ответ: 32,68 г/моль. 7. Вычислите количество вещества эквивалента и молярную массу эквивалента Н3РО4 в реакциях образования: а) гидроортофосфата; б) дигидроортофосфата; в) ортофосфата. 8. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярную массу эквивалента металла и его оксида. Чему равна молярная и относительная атомная масса этого металла? 9. Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.) Вычислите молярную массу эквивалента, молярную массу и относительную атомную массу этого металла. 10. Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите молярную массу эквивалента этого металла. Ответ: 103,6 г/моль. 11. Напишите уравнения реакций Fe(OH)3 с хлороводородной (соляной) кислотой, в которых образуются следующие соединения железа: а) хлорид дигидроксожелеза (III); б) хлорид гидроксожелеза (III); в) хлорид железа (III). Вычислите количество вещества эквивалента и молярную массу эквивалента Fe(OH)3 в каждой из этих реакций. 12. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнение реакций этих веществ с КОН и определите для этих веществ количество вещества эквивалентов и молярные массы эквивалентов. 13. Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) хлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с HCl и определите для этих веществ количество вещества эквивалентов и молярные массы эквивалентов. 14. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите молярные массы эквивалента металла и его оксида. Чему равны молярная и относительная атомная массы металла? Ответ: 27,9 г/моль; 35,9 г/моль; 55,8 г/моль; 55,8. 15. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите молярную массу эквивалента, молярную и относительную атомную массы металла. 16. Исходя их молярной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах. Ответ: 2,0∙10-23 г; 3,0∙10-23 г. 17. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NaOH. Вычислите количество вещества эквивалента, молярную массу эквивалента и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции. Ответ: 0,5 моль; 49 г/моль; 2. 18. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите количество вещества эквивалента, молярную массу эквивалента и основность кислоты. На основании расчета напишите уравнение реакции. Ответ: 0,5 моль; 41 г/моль; 2. 19. Вычислите число атомов азота в 20 г карбамида (NH2)2CO, содержащего 10% неазотистых примесей. 20. В тонне морской воды содержится около 50 миллиардов атомов золота. Приняв, что 30 капель воды имеют массу 1 г, вычислите массу золота в 1 г морской воды. 21. Сколько молекул оксида серы (IV) образуется при сжигании 2 г серы? 22. При сгорании металла массой 3 г образуется его оксид массой 5,67 г. Степень окисления металла в оксиде равна +3. Что это за металл? 23. Во сколько раз в земной коре атомов кислорода больше, чем атомов кремния? Массовые доли кислорода и кремния равны 0,47 и 0,295 соответственно. 24. При взаимодействии 1,04 г некоторого металла с раствором кислоты выделилось 0,448 л водорода (н.у.). Определите этот металл. 25. Сколько граммов хлорида железа (III) необходимо для приготовления 2 л 0,5н раствора? 26. Какая масса серной кислоты содержится в 1 л 0,5н раствора? 27. Сколько граммов хлорида бария содержится в 25 мл 0,5н раствора? 28. Какой объем 0,2н раствора Н2SO4 потребуется для нейтрализации 500 мл 0,1н раствора NaOH? 29. Какой объем 0,1н раствора НCl потребуется на нейтрализацию раствора, содержащего 0,56 г КOH? 30. Какова нормальность раствора NaOH, если на нейтрализацию 150 мл этого раствора пошло 80 г 5% раствора серной кислоты? 31. При взаимодействии фосфата кальция с углеродом и оксидом кремния 32. Сколько миллилитров раствора 0,1н К2SO4 потребуется для осаждения сульфата бария из 50 г 5%-го раствора? 33. Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов? 34. Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 26. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов? 35. Какое максимальное число электронов могут занимать s-, p-, d- и f-орбитали данного энергетического уровня? Почему? Напишите электронную формулу атома элемента с порядковым номером 31. 36. Какие орбитали атома заполняются электронами раньше: 4s или 3d; 5s или 4p? Почему? Напишите электронную формулу атома элемента с порядковым номером 21. 37. Какие орбитали атома заполняются электронами раньше: 4d или 5s; 6s или 5p? Почему? Напишите электронную формулу атома элемента с порядковым номером 43. 38. Напишите электронные формулы атомов элементов с порядковыми номерами 14 и 40. Сколько свободных 3d-орбиталей у атомов последнего элемента? 39. Напишите электронные формулы атомов элементов с порядковыми номерами 21 и 23. Сколько свободных 3d-орбиталей в атомах этих элементов? 40. Сколько свободных d-орбиталей содержится в атомах Sc, Ti, V? Напишите электронные формулы атомов этих элементов. 41. Пользуясь правилом Гунда, распределите электроны по квантовым ячейкам, отвечающим низшему энергетическому состоянию атомов: хрома, фосфора, серы, германия, никеля. 42. Для атома бора возможны два различных электронных состояния 43. Атому какого из элементов отвечает каждая из приведенных электронных формул: ......................? 44. Атомам каких элементов и каким состояниям этих элементов отвечают следующие электронные формулы ... и ...; ... и ...? 45. Пользуясь правилом Гунда, распределите электроны по квантовым ячейкам, отвечающим высшему энергетическому состоянию атомов: марганца, азота, кислорода, кремния, кобальта. 46. Напишите электронную конфигурацию атомов, пользуясь электронными формулами для элементов с порядковыми номерами 12, 25, 31, 34, 45. 47. Пользуясь правилом Гунда, распределите электроны по энергетическим ячейкам, соответствующим низшему энергетическому состоянию, для атомов элементов с порядковыми номерами 26, 39, 49, 74, 52. 48. Какие из электронных формул, отражающих строение невозбужденного атома некоторого элемента, неверны: а) 1s22s22p53s1; б) 1s22s22p6; в) 1s22s22p63s23p63d4; г) 1s22s22p63s23p64s2; д) 1s22s22p63s23d2? Почему? Атомам каких элементов отвечают правильно составленные электронные формулы? 49. Напишите электронные формулы атомов элементов с порядковыми номерами 24 и 33, учитывая,... что у первого происходит «провал» одного 4s-электрона на 3d-подуровень. Чему равен максимальный спин d-электронов у атомов первого и p-электронов у атомов второго элемента? 50. В чем заключается принцип Паули? Может ли быть на каком-нибудь подуровне атома р7- или d12-электронов? Почему? Составьте электронную формулу атома элемента с порядковым номером 22 и укажите его валентные электроны. 51. Составьте электронные формулы атомов элементов с порядковыми номерами 32 и 42, учитывая, что у последнего происходит «провал» одного 5s-электрона на 4d-подуровень. К какому электронному семейству относится каждый из этих элементов? 52. Определите по правилу Клечковского порядок заполнения электронами подуровней в атомах элементов, если их суммы n+1 соответственно равны 4, 5 и 6? 53. Сколько свободных f-орбиталей содержится в атомах элементов с порядковыми номерами 61, 62, 91, 92? Пользуясь правилом Гунда, распределите электроны по энергетическим ячейкам для атомов этих элементов. 54. В атомах каких элементов IV периода наибольшее число непарных d-электронов? Представьте структуру d-подуровней атомов этих элементов. 55. Составьте электронные формулы еще не открытых элементов № 108 и 113 и укажите, какое место они займут в периодической системе. 56. Что такое изотопы? Чем можно объяснить, что у большинства элементов периодической системы атомные массы выражаются дробным числом? Могут ли атомы разных элементов иметь одинаковую массу? Как называются подобные атомы? 57. Изотоп никеля-57 образуется при бомбардировке α-частицами ядер атомов железа-54. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме. 58. Изотоп кремния-30 образуется при бомбардировке α-частицами ядер атомов алюминия-27. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме. 59. Изотоп углерода-11 образуется при бомбардировке протонами ядер атомов азота-14. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме. 60. Сколько и какие значения может принимать магнитное квантовое число ml при орбитальном числе l = 0, 1, 2 и 3? Какие элементы в периодической системе называют s-, p-, d- и f-элементами? Приведите примеры. 61. Какие значения могут принимать квантовые числа n, l, ml и mS, характеризующие состояние электронов в атоме? Какие значения они принимают для внешних электронов атома магния? 62. Квантовые числа для электронов внешнего энергетического уровня атомов некоторых элементов имеют следующие значения: n = 4; l = 0; ml = 0; mS = .... Напишите электронные формулы атомов этих элементов и определите сколько свободных 3d-орбиталей содержит каждый их них. 63. Для атома с электронной структурой ... впишите в таблицу значения четырех квантовых чисел: n, l, ml, mS, определяющие каждый из элементов в нормальном состоянии:
64. Энергетическое состояние внешнего электрона атома описывается следующими значениями квантовых чисел: n=4, l=0, ml=0. Атомы каких элементов имеют такой электрон? Составьте электронные формулы атомов этих элементов. Напишите все квантовые числа эля электронов атомов: а) лития, бериллия, углерода; б) азота, кислорода, фтора. 65. Напишите значения квантовых чисел ml и mS для тех четырнадцати электронов, для которых главное и орбитальное число соответственно равны 4 и 3. 66. Напишите электронные формулы атомов элементов и назовите их, если значения квантовых чисел (n, l, ml, mS) электронов наружного электронного слоя следующие: а) 2, 0, 0, +...; 2, 0, 0, -...; б) 3, 1, -1, -...; 3, 1, +1, -.... Охарактеризуйте квантовыми числами следующие состояния электронов. ............................. 67. Напишите электронные формулы атомов элементов и назовите их, если значения квантовых чисел (n, l, ml, mS) электронов наружного (последнего) и предпоследнего электронных слоев следующие: а) 6, 0, 0, +...; 6, 0, 0, -...; 6, 1, -1, +...; б) 3, 2, -2, +...; 3, 2, -1, +...; 4, 0, 0, +...; 4, 0, 0, -.... 68. Исходя из положения германия и технеция в периодической системе, составьте формулы мета- и ортогерманиевой кислот, и оксида технеция, отвечающие их высшей степени окисления. Изобразите формулы этих соединений графически. 69. Что такое энергия ионизации? В каких единицах она выражается? Как изменяется восстановительная активность s- и p-элементов в группах периодической системы с увеличением порядкового номера? Почему? 70. Что такое электроотрицательность? Как изменяется электроотрицательность р-элементов в периоде, в группе периодической системы с увеличением порядкового номера? Почему? 71. Что такое сродство к электрону? В каких единицах оно выражается? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера? Ответ мотивируйте строением атома соответствующего элемента. 72. Составьте формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. Как изменяется кислотно-основный характер этих соединений при переходе от натрия к хлору? Напишите уравнения реакций, доказывающих амфотерность гидроксида алюминия. 73. Какой из элементов четвертого периода – ванадий или мышьяк – обладает более выраженными металлическими свойствами? Какой их этих элементов образует газообразное соединение с водородом? Ответ мотивируйте, исходя из строения атомов данных элементов. 74. Марганец образует соединения, в которых он проявляет степень окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида марганца (IV). 75. У какого элемента четвертого периода – хрома или селена – сильнее выражены металлические свойства? Какой их этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена. 76. Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой степени окисления. Как называются соответствующие соединения? 77. У какого из р-элементов пятой группы периодической системы – фосфора или сурьмы – сильнее выражены неметаллические свойства? Какое из водородных соединений данных элементов более сильный восстановитель? Ответ мотивируйте строением атома этих элементов. 78. Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: Ba(OH)2 или Mg(OH)2; Ca(OH)2 или Fe(OH)2; Cd(OH)2 или Sr(OH)2? 79. Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: CuOH или Cu(OH)2; Fe(OH)2 или Fe(OH)3; Sn(OH)2 или Sn(OH)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II). 80. Какую низшую степень окисления проявляют водород, фтор, сера и азот? Почему? Составьте формулы соединений кальция с данными элементами в этой степени окисления. Как называются соответствующие соединения? 81. Какую низшую и высшую степени окисления проявляют кремний, мышьяк, селен и хлор? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. 82. Хром образует соединения, в которых он проявляет степени окисления +2, +3, +6. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающие амфотерность гидроксида хрома (III). 83. Атомные массы элементов в периодической системе непрерывно увеличиваются, тогда как свойства простых тел изменяются периодически. Чем это можно объяснить? Дайте мотивированный ответ. 84. Какова современная формулировка периодического закона? Объясните, почему в периодической системе элементов аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, йодом и протактинием, хотя и имеют большую атомную массу? 85. Какую низшую и высшую степени окисления проявляют углерод, фосфор, сера и йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. 86. Атомы каких элементов четвертого периода периодической системы образуют оксид, отвечающий их высшей степени окисления Э2О5? Какой из них дает газообразное соединение с водородом? Составьте формулы кислот, соответствующих этим оксидам, и изобразите их графически. 87. Исходя из величин потенциалов ионизации, укажите, какой из приведенных элементов: Be, Mg, Ca, Sr, Ba – проявляет наиболее ярко выраженные металлические свойства? 88. Укажите, как в приведенном ряду элементов O, S, Se, Te изменяется способность принимать электроны, если известны величины электроотрицательности атомов этих элементов. 89. Как изменяются свойства элементов II периода периодической системы с увеличением заряда ядра атома элемента? Ответ подтвердите характером формирования электронных оболочек атомов элементов. 90. Укажите, какое из сравниваемых двух соединений является более сильным основанием: а) NaOH или CsOH; б) Ca(OH)2 или Ba(OH)2; в) Zn(OH)2 или Cd(OH)2. 91. Как меняется восстановительная способность и сила кислот в ряду HF→ HCl→ HBr → HI? 92. У какого из элементов четвёртого периода – ванадия или мышьяка – сильнее выражены металлические свойства и почему? 93. Какие водородные соединения образуют p-элементы второго периода? Как изменяется прочность и кислотные свойства этих соединений в периоде слева направо? 94. Элемент в периодической системе имеет порядковый номер 25. Какие оксиды образует этот элемент? Какие свойства проявляют оксиды этого элемента? Образует ли этот элемент газообразные соединения с водородом? 95. Определите степень окисления фосфора в соединениях: PH3; H3PO4; Na4P2O7; Mg3P2; NaH2PO3. 96. Какое строение электронных слоёв у элементов подгруппы хрома при степени их окисления +3? Как изменяются основные свойства гидроксидов этих металлов по подгруппе сверху вниз? 97. Каков характер изменения свойств элементов в V периоде периодической системы? Какой порядок заполнения электронных оболочек атомов элементов этого периода? 98. Структуры внешнего и предвнешнего электронных слоёв атомов элементов следующие: 3s23p63d54s2; 4s24p64d55s2; 5s25p65d56s2. Назовите эти элементы. К какому электронному семейству они относятся? Как меняются окислительные свойства оксидов этих элементов, отвечающих высшим степеням их окисления? 99. Как изменяется устойчивость и сила кислот в ряду H2SO3 → H2SeO3 → H2TeO3? Ответ обоснуйте. 100. Вычислите степень окисления серы в соединениях: K2S2O3; Na2S2O7; (NH4)2S2O8; Na2S; S8. 101. Какое положение занимает химический элемент хлор в периодической системе элементов Д.И. Менделеева? Какие степени окисления характерны для хлора? Как изменяются кислотные, окислительные свойства и термическая устойчивость в ряду кислородосодержащих кислот хлора? 102. Как изменяются термическая устойчивость, растворимость в воде и основные свойства гидроксидов щелочных металлов в ряду LiOH→CsOH? 103. Почему в ряду Ca-Sr-Ba уменьшается поляризующее действие элементов? Объясните эту закономерность на примере термического разложения карбонатов и гидроксидов щелочноземельных элементов. 104. Как изменяются основные свойства гидроксидов в ряду Ce3+→Lu3+? Ответ мотивируйте сравнением радиусов ионов этих элементов. Как меняется растворимость гидроксидов в этом ряду? 105. Какую химическую связь называют ковалентной? Чем можно объяснить направленность ковалентной связи? Как метод валентных связей (ВС) объясняет строение молекулы воды? 106. Какую ковалентную связь называют полярной? Что служит количественной мерой полярности ковалентной связи? Исходя из значений электроотрицательности атомов соответствующих элементов определите, какая из связей: HCl, ICl, BrF – наиболее полярна. 107. Какой способ образования ковалентной связи называют донорно-акцепторным? Какие химические связи имеются в ионах NH4+ и BF4-? Укажите донор и акцептор. 108. Как метод валентных связей (ВС) объясняет линейное строение молекулы BeCl2 и тетраэдрическое СН4? 109. Какую ковалентную связь называют σ-связью и какую π-связью? Разберите на примере строения молекулы азота. 110. Сколько неспаренных электронов имеет атом хлора в нормальном и возбужденном состояниях? Распределите эти электроны по квантовым ячейкам. Чему равна валентность хлора, обусловленная неспаренными электронами? 111. Распределите электроны атома серы по квантовым ячейкам. Сколько неспаренных электронов имеют ее атомы в нормальном и возбужденном состояниях? Чему равна валентность серы, обусловленная неспаренными электронами? 112. Что называют электрическим моментом диполя? Какая из молекул HCl, HBr, HI имеет наибольший момент диполя? Почему? 113. Какие кристаллические структуры называют ионными, атомными, молекулярными и металлическими? Кристаллы каких веществ – алмаз, хлорид натрия, диоксид углерода, цинк – имеют указанные структуры? 114. Как метод валентных связей (ВС) объясняет угловое строение молекулы H2S и линейное молекулы СО2? 115. Нарисуйте энергетическую схему образования молекулы Не2 и молекулярного иона Не2+ по методу молекулярных орбиталей. Как метод МО объясняет устойчивость иона Не2+ и невозможность существования молекулы Не2? 116. Какую химическую связь называют водородной? Между молекулами каких веществ она образуется? Почему Н2О и НF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем их аналогии? 117. Какую химическую связь называют ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите два примера типичных ионных соединений. Напишите уравнения превращения соответствующих ионов в нейтральные атомы. 118. Что следует понимать под степенью окисления атома? Определите степень окисления атома углерода и его валентность, обусловленную числом неспаренных электронов, в соединениях СН4, СН3ОН, НСООН, СО2. 119. Какие силы межмолекулярного взаимодействия называют ориентационными, индукционными и дисперсионными? Когда возникают эти силы и какова их природа? 120. Нарисуйте энергетическую схему образования молекулярного иона Н2- и молекулы Н2 по методу молекулярных орбиталей. Где энергия связи больше? Почему? 121. Какие электроны атома бора участвуют в образовании ковалентных связей? Как метод валентных связей (ВС) объясняет симметричную треугольную форму молекулы BF3? 122. Нарисуйте энергетическую схему образования молекулы О2 по методу молекулярных орбиталей (МО). Как метод МО объясняет парамагнитные свойства молекулы кислорода? 123. Нарисуйте энергетическую схему образования молекулы F2 по методу молекулярных орбиталей (МО). Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этой молекуле? 124. Ковалентный радиус атома иода равен 1,33×10-10 м. Рассчитайте приблизительные ядерные расстояния в молекулах иода и иодида водорода, если ковалентный радиус водорода равен 0,30×10-10 м. Ответ: 2,66×10-10 м, 1,63×10-10 м. 125. Вычислите длину связи С–Н в СН4 по следующим данным: длины связей С–С и Н–Н соответственно равны: 1,54×10-10 м и 0,74×10-10 м. Ответ: 1,14×10-10 м. 126. Произведите приблизительную оценку длины связей в молекулах NO и SO, если межядерные расстояния в молекулах N2O2 и S2 соответственно равны: 1,09×10-10 м, 1,20×10-10 м и 1,92×10-10 м. Ответ: 1,14×10-10 м; 1,56×10-10 м. 127. Вычислите энергию s-p ковалентной связи Н–S в молекуле Н2S по следующим данным: 2H2(г)+ S2(г)=2Н2S(г)–40,30 кДж; энергии связей Н–Н и S–S соответственно равны –435,9 кДж/моль и –417,6 кДж/моль. Ответ:–332,43 кДж/моль. 128. Вычислите энергию кратной связи (...) в молекуле этилена, если стандартная теплота образования С2Н2 из простых веществ равна 52,28 кДж/моль. Теплота возгонки графита равна +715,88 кДж/моль, а энергия диссоциации водорода равна 435,9 кДж/моль. Энергия связи С–Н равна –423,4 кДж/моль. Ответ:–557,68 кДж/моль. 129. Определите среднюю энергию связи Р–Н в молекуле РH3, если .... а энергия диссоциации Р2 и Н2 соответственно равны 489,1 кДж/моль и 435,9 кДж/моль. Ответ:–293,74 кДж/моль. 130. Рассчитайте среднюю энергию связи кислород–водород в молекуле воды, если энергия связей Н–Н и О–О соответственно равны –435,9 кДж/моль и –498,7 кДж/моль, а при сгорании 2 моль водорода выделяется 483,68 кДж теплоты. Ответ:–463,55 кДж/моль. 131. Дипольный момент молекулы NO равен 0,053×10-29 Кл×м. Вычислите длину диполя молекулы NO. Ответ: 0,03×10-10 м. 132. Длина диполя молекулы HF равна 0,4×10-10 м. Рассчитайте дипольный момент молекулы HF. Ответ: 0,64×10-29 Кл×м. 133. Какую валентность может проявлять иод в своих соединениях? Изобразите структуру атома иода в нормальном и возбужденном состоянии. 134. Как изменяется величина валентного угла ... в ряду ...? Ответ дайте на основании метода валентных связей. 135. Сколько ...связей в молекулах ... Изобразите перекрывание электронных облаков в этих молекулах. 136. Изобразите схему образования молекулярных орбиталей в молекуле ... из атомов углерода и водорода. 137. Почему п-нитрофенол имеет намного более высокую температуру кипения, чем о-нитрофенол? 138. Вычислите количество теплоты, которое выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. Ответ: 2543,1 кДж. 139. Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4(г) и водяных паров. Напишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. Ответ: -45,76 кДж. 140. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений: FeO(к) + СО(г) = Fe(к) + СО2(г); ∆Н1 = -13,18 кДж; СО(г) + ...О2(г) = СО2(г); ∆Н2 = -283,0 кДж; Н2(г) + ...О2(г) = Н2О(г); ∆Н3 = -241,83 кДж. Ответ: +27,99 кДж. 141. При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод СS2(г). Напишите термохимическое уравнение этой реакции, предварительно вычислите ее тепловой эффект. Ответ: +65,43 кДж. 142. Напишите термохимическое уравнение реакции между СО(г) и водородом, в результате которой образуются СН4(г) и Н2О(г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия? Ответ: 618,48 кДж. 143. Тепловой эффект какой реакции равен теплоте образования NO? Вычислите теплоту образования NO, исходя из следующих термохимических уравнений: 4NH3 + 5O2(г) = 4NO(г) + 6Н2О(ж); ∆Н1 = -1168,80 кДж; 4NH3 + 3O2(г) = 2N2(г) + 6Н2О(ж); ∆Н2 = -1530,28 кДж. Ответ: 90,37 кДж. 144. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлороводорода. Напишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ: 78,97 кДж. 145. Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений: Н2(г) + ...О2(г) = Н2О; ∆Н1 = -285,84 кДж; С(к) + О2(г) = СО2(г); ∆Н2 = -393,51 кДж; СН4(г) + 2О2(г) = 2Н2О(ж) + СО2(г); ∆Н3 = -890,31 кДж. Ответ: -74,88 кДж. 146. Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений: Са(к) + ...О2(г) = СаО(к); ∆Н1 = -635,60 кДж; Н2(г) + ...О2(г) = Н2О(ж); ∆Н2 = -285,84 кДж; СаО(к) + Н2О(ж) = Са(ОН)2(к); ∆Н3 = -65,06 кДж. Ответ: -986,50 кДж. 147. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6(ж). Ответ: +49,03 кДж. 148. Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж. 149. При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж. 150. Реакция горения метилового спирта выражается термохимическим уравнением СН3ОН (ж) + ...О2(г) = СО2(г) + 2Н2О(ж); ∆Н = ? Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования СН3ОН(ж) равна +37,4 кДж. Ответ: -726,62 кДж. 151. При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: -277,67 кДж. 152. При какой температуре наступит равновесие системы 4HCl(г) + О2(г) ↔ 2Н2О(г) + 2Сl2(г); ∆Н =-114,42 Дж. Хлор или кислород в этой системе является более сильным окислителем и при какой температуре? Ответ: 891К. 153. Восстановление Fe3O4 оксидом углерода идет по уравнению Fe3O4(к) + CO(г) = 3FeO(к) + CO2(г). Вычислите ∆G0298 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно ∆S0298 в этом процессе? Ответ: +24,19 кДж; +31,34 Дж/К. 154. Реакция горения ацетилена протекает по уравнению С2Н2(г) + ...О2 (г) = 2СО2(г) + Н2О(ж) Вычислите ∆G0298 и ∆S0298. Объясните уменьшение энтропии в результате этой реакции. Ответ: -1235,15 кДж; -216,15 Дж/(моль∙К). 155. Уменьшается или увеличивается энтропия при переходах а) воды в пар; б) графита в алмаз? Почему? Вычислите ∆S0298 для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях. Ответ: а) 118,78 Дж/(моль∙К); б) -3,25 Дж/(моль∙К). 156. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция Н2 (г) + СО2(г) = СО(г) + Н2О(ж); ∆Н = -2,85 кДж. Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите ∆G0298 этой реакции. Ответ: -19,91 кДж. 157. Прямая или обратная реакция будет протекать при стандартных условиях в системе 2NO(г) + О2(г) ↔ 2NO2(г). Ответ мотивируйте, вычислив ∆G0298 прямой реакции. Ответ: -69,70 кДж. 158. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите ∆G0298 реакции, протекающей по уравнению NH3 (г) + HCl(г) = NH4Cl(к). Может ли эта реакция при стандартных условиях идти самопроизвольно? Ответ: -92,08 кДж. 159. При какой температуре наступит равновесие системы СН4(г) + СО2(г) ↔ 2СО(г) + 2Н2(г); ∆Н = +247,37 кДж? 160. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите ∆G0298 реакции, протекающей по уравнению 4NH3(г) + 5О2(г) = 4NO(г) + 6Н2О(г). Возможна ли эта реакция при стандартных условия: Ответ: -957,77 кДж. 161. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите ∆G0298 реакции, протекающей по уравнению СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(ж). Возможна ли эта реакция при стандартных условиях? Ответ: -130,89 кДж. 162. Вычислите ∆Н0, ∆S0, ∆G0Т реакции, протекающей по уравнению Fe2O3(к) + 3Н2(г) = 2Fe(к) + 2Н2О(г). Возможна ли реакция восстановления Fe2O3 водородом при 500 и 2000 К? Ответ: +96,61 кДж; 138,83 Дж/К; 27,2 кДж; -181,05 кДж. 163. Какие из карбонатов: ВеСО3, СаСО3 или ВаСО3 – можно получить при взаимодействии соответствующих оксидов с СО2? Какая реакция протекает наиболее энергично? Вывод сделайте, вычислив ∆G0298 реакций. Ответ: +31,24 кДж; -130,17 кДж; -216,02 кДж. 164. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите ∆G0298 реакции, протекающей по уравнению СО(г) + 3Н2(г) = СН4(г) + Н2О(г). Возможна ли эта реакция при стандартных условиях? Ответ: -1452,16 кДж. 165. Вычислите ∆НО, ∆SО, ∆GОТ реакции, протекающей по уравнению TiO2(к) +2C(к) = Ti(к) + 2СО(г). Возможна ли реакция восстановления TiO2 углеродом при 1000 и 3000 К? Ответ: +722,86 кДж; 364,84 Дж/К; +358,02 кДж; -371,66 кДж. 166. Каков знак изменения энтропии в процессе кипения воды? 167. Каков знак изменения энтропии в процессе образования гидроксокомплекса Cr(III): ...? 168. При стандартных условиях реакция ... протекает самопроизвольно. Определите знаки ∆Н и ∆S в этой системе. 169. Расположите указанные соединения: ... в порядке увеличения энтропии. Обоснуйте этот ряд. 170. Тепловой эффект реакции ... равен –560,0 кДж. Вычислите стандартную теплоту образования .... Ответ: 83,24 кДж/моль. 171. Рассчитайте ..., если известно, что .... Ответ: –165,24 кДж/моль. 172. Окисление аммиака протекает по уравнению .... Определите ... и ..., если теплота растворения ... в воде равна –34,65кДж. Ответ: –46,76 кДж/моль; –367,25 кДж/моль. 173. Рассчитайте расход тепловой энергии при реакции ..., если было получено 336г железа. Ответ: –2561,0 кДж. 174. Сколько теплоты выделится при сгорании 825л ацетилена ..., если конечными продуктами сгорания являются ... и .... Ответ: –46244,5 кДж. 175. Найдите изменение внутренней энергии при испарении 75г этилового спирта при температуре кипения, если удельная теплота его испарения равна 857,7 Дж/г, а удельный объем пара при температуре кипения равен 607 см3/г. Объемом жидкости пренебречь. (Ответ: 58,39 кДж). 176. Определите ... при испарении 360г воды при ..., допуская, что пары воды подчиняются законам идеальных газов и что объем жидкости незначителен по сравнению с объемом пара. Удельная теплота парообразования воды 2451Дж/г. Ответ: 833,64 кДж/моль. 177. Изменение внутренней энергии системы .. равно –334,0 кДж. Рассчитайте ...для этой реакции. Условия стандартные. Ответ: –336,3 кДж/моль. 178. На основе значений ... приведенных ниже оксидов германия, олова и свинца, укажите, какие из них являются окислителями, какие – восстановителями: ...; ...; .... 179. Пользуясь значениями ... реагирующих веществ, вычислите ... реакции ... и определите, может ли она осуществиться при стандартных условиях. 180. Можно ли использовать при стандартных условиях приведенную реакцию для получения аммиака: ...? Ответ обоснуйте подсчетом ... реакции. 181. Вычислите ... в ходе реакции: .... Ответ: 9,9 Дж/(моль·К). 182. Определите ... системы .... Ответ: 160,4 Дж/(моль·К). 183. Подсчитав ... реакции, определите, какая из двух термодинамически возможна: ..., .... 184. Вычислите значения ..., ..., ... для процесса .... В каком направлении эта реакция протекает самопроизвольно при стандартных условиях? 185. Подсчитав тепловой эффект и изменение энергии Гиббса при 25ºC для реакции ..., определите ...для этой реакции. Ответ: –412,4 Дж/(моль·К). 186. Подсчитав ... реакции на основании ... и ... реагирующих веществ, определите возможность протекания реакции ... при стандартных условиях: ...;...; ...; .... 187. Определите возможность превращения при стандартных условиях ацетилена в бензол. Ответ дайте, подсчитав ... процесса на основе ... и ...... и .... 188. В растворе протекает реакция .... Напишите кинетическое уравнение этой реакции, если ее скорость возрастает в 4 раза при увеличении концентрации вещества А в 2 раза и не зависит от концентрации вещества В. Как изменится скорость реакции при разбавлении раствора в 2 раза? 189. Установлено, что газовая реакция, протекающая по уравнению ... имеет первый порядок по веществу А и первый - по веществу В. Как изменится скорость реакции при снижении давления в системе в 3 раза? 190. Во сколько раз увеличится скорость реакции ... при увеличении температуры от 140 до 180оС, если температурный коэффициент реакции равен 2? 191. Во сколько раз возрастет скорость реакции при увеличении температуры от 20 до 100оС, если энергия активации равна 125 кДж/моль? 192. В реакции обжига серного колчедана, осуществляемой при высоких температурах (свыше 600оС) ... практически не образуется ..., который получают далее на отдельной стадии согласно реакции ... (...). Почему обе эти стадии нельзя совместить в одном реакционном аппарате? 193. В газовой фазе протекают две реакции: основная ... (1) и побочная ... (2). Как изменится соотношение скоростей основной и побочной реакций при увеличении давления в 3 раза, если скорость реакций (1) и (2) описывается уравнениями ... ? 194. Две реакции одинакового порядка имеют энергии активации 80 и 120 кДж/моль. Рассчитайте соотношение предэкспоненциальных множителей реакций, если соотношение их скоростей при 300о С равно 4? 195. С какой целью реакцию получения стирола ... осуществляют при разбавлении газов реакции водяным паром? 196. Газофазная реакция ..., являющаяся стадией получения серной кислоты, описывается кинетическим уравнением .... Как изменится скорость этой реакции при увеличении давления в 3 раза? 197. Газофазная реакция ..., являющаяся стадией получения серной кислоты, описывается кинетическим уравнением .... Как изменится скорость этой реакции, протекающей при соотношении реагентов ..., если: а) увеличить избыток SО2 по отношению к О2; б) увеличить избыток О2 по отношению к стехиометрическому количеству О2? 198. Как повлияют на обратимую реакцию получения стирола ..., ... следующие воздействия: а) увеличение давления; б) повышение температуры; в) разбавление реагентов инертным газом? 199. Как повлияют на реакцию синтеза аммиака ... следующие воздействия: а) уменьшение температуры; б) снижение давления; в) разбавление газов реакции азотом? 200. Дана система реакций, протекающих в газовой фазе ... Как повлияет на соотношение продуктов этих реакций: а) увеличение давления, б) увеличение концентрации водорода? 201. Дана реакция .... Как повлияют на эту реакцию: а) понижение температуры; б) понижение давления; в) разбавление компонентов реакции инертным газом? 202. Дана реакция .... Как повлияет на положение равновесия отгонка в ходе реакции эфира ROR из реакционной массы? 203. Дана реакция .... Как повлияют на эту реакцию: а) увеличение температуры; б) увеличение давления; в) разбавление компонентов реакции инертным газом? 204. Окисление серы и ее диоксида протекает по уравнениям: а) S (к) + О2 = SO2 (г); б) 2SO2 (г) + О2 = 2SO3 (г). Как изменится скорость этих реакций, если объемы каждой из систем уменьшить в четыре раза? 205. Напишите выражение для константы равновесия гомогенной системы N2 + 3H2 ↔ 2NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в три раза? 206. Реакция протекает по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были [N2]= 0,049 моль/л, [О2]= 0,01 моль/л. Вычислите концентрацию этих веществ, когда [NО]= 0,005 моль/л. Ответ: [N2]=0,0465 моль/л; [О2]= 0,0075 моль/л. 207. Реакция протекает по уравнению N2 + 3Н2 = 2NН3. Концентрации участвующих в ней веществ (моль/л): [N2]= 0,80; [Н2]= 1,5; [NH3]= 0,10. Вычислите концентрацию водорода и аммиака, когда [N2]= 0,5 моль/л. Ответ: [NН3]=0,70 моль/л; [Н2]= 0,60 моль/л. 208. Реакция протекает согласно уравнению Н2 + I2 = 2HI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ (моль/л): [Н2]= 0,04; [I2]= 0,05. Вычислите начальную скорость реакции и ее скорость при [Н2]= 0,03 моль/л. Ответ: 3,2∙10-4; 1,92∙10-4. 209. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80оС? Температурный коэффициент скорости реакции 3. 210. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60оС, если температурный коэффициент скорости данной реакции 2? 211. В гомогенной системе СО + Cl2 ↔ COCl2 равновесные концентрации реагирующих веществ (моль/л): [СО] = 0,2; [Cl2] = 0,3; [COCl2] = 1,2. Вычислите константу равновесия системы и исходные концентрации Cl2 и CO. Ответ: К = 20; [Cl2]исх = 1,5 моль/л; [CО]исх. = 1,4 моль/л. 212. В гомогенной системе А + 2В ↔ С равновесные концентрации реагирующих газов (моль/л): [А] = 0,06; [В] = 0,12; [С] = 0,216. Вычислите константу равновесия системы и исходные концентрации веществ А и В. Ответ: К = 250; [А]исх. = 0,276 моль/л; [В]исх. = 0,552 моль/л. 213. В гомогенной газовой системе А + 2В ↔ С + D равновесие установилось при концентрациях (моль/л): [В] = 0,06 и [С] = 0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В. Ответ: [А]исх. = 0,22 моль/л; [В]исх. = 0,07 моль/л. 214. Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O = 2N2 + O2, равна 5∙10-4. Начальная концентрация N2О равна 6,0 моль/л. Вычислите начальную скорость реакции и скорость реакции в момент, когда разложится 50% N2O. Ответ: 1,8∙10-2; 4,5∙10-3. 215. Напишите выражение для константы равновесия гетерогенной системы СО2 + С ↔ 2СО. Как изменится скорость прямой реакции – образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО? 216. Напишите выражение для константы равновесия гетерогенной системы С + Н2О (г) ↔ СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров? 217. Равновесие гомогенной системы 4НСl (г) + О2(г) ↔ 2Н2О(г) + 2Сl2(г) установилось при следующих концентрациях реагирующих веществ (моль/л): [Н2О]р = 0,14; [Cl2]р = 0,14; [НCl]р = 0,20; [О2]р = 0,32. Вычислите исходные концентрации хлороводорода и кислорода. Ответ: [НCl]исх. = 0,48 моль/л; [О2]исх. = 0,39 моль/л. 218. Вычислите константу равновесия для гомогенной системы СО (г) + H2О (г) ↔ СО2 (г) + Н2 (г), если равновесные концентрации реагирующих веществ (моль/л): [СО]р = 0,004; [Н2О]р = 0,064; [CО2]р = 0,016; [Н2]р = 0,016. Чему равны исходные концентрации воды и СО? Ответ: К=1; [Н2О]исх. = 0,08 моль/л; [СО]исх. = 0,02 моль/л. 219. Константа равновесия гомогенной системы СО (г) + Н2О (г) ↔СО2 (г) + Н2 (г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации равны (моль/л): [CО]исх. = 0,10; [Н2О]исх. = 0,40. Ответ: [СО2]р = [Н2]р = 0,08 моль/л; [CО]р = 0,02 моль/л; [Н2О]р = 0,32 моль/л. 220. Константа равновесия гомогенной системы N2 + 3H2 ↔ 2NН3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрации азота. Ответ: [N2]р = 8 моль/л; [N2]исх. = 8,04 моль/л. 221. Исходные концентрации [NО]исх. и [Cl2]исх. в гомогенной системе 2NO + Cl2 ↔ 2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO. Ответ: 0,416. | ||||||||||||||||||||||||||||||

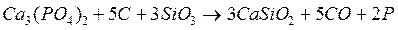 получено 3,1 г фосфора. Определите массы эквивалентов углерода и фосфата кальция в этой реакции.
получено 3,1 г фосфора. Определите массы эквивалентов углерода и фосфата кальция в этой реакции.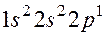 и
и 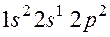 . Как называют эти состояния? Как перейти от первого состояния ко второму?
. Как называют эти состояния? Как перейти от первого состояния ко второму?