| Общая информация » Каталог студенческих работ » ЕСТЕСТВЕННЫЕ ДИСЦИПЛИНЫ » Химия |
| 03.11.2017, 13:41 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
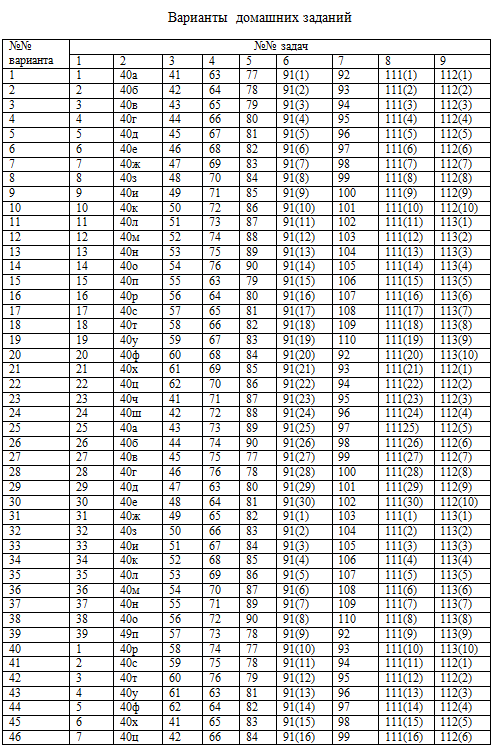
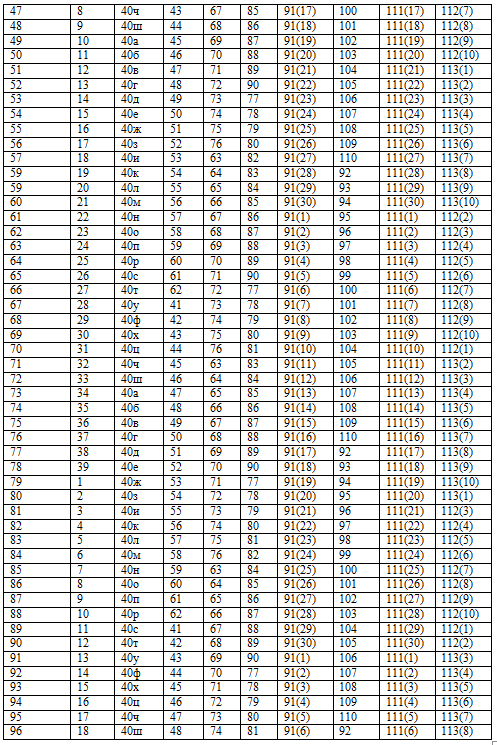
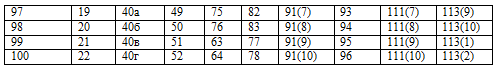
Каждый студент выполняет вариант контрольных заданий, обозначенный двумя последними цифрами номера студенческого билета (шифра). Например, номер студенческого билета 3038524, две последние цифры - 24, им соответствует вариант контрольного задания 24. Контрольное задание 1 1. Энергетика химических процессов 1. Напишите термохимическое уравнение, соответствующее табличному значению DH0обр(NH3). Сколько тепла выделится, если в результате реакции образуется 2 моль NH3? 2. Напишите термохимическое уравнение, соответствующее табличному значению DH0обр(H2O). Cколько тепла выделится при образовании 1 кг H2O(ж)? 3. Напишите термохимическое уравнение, соответствующее табличному значению DH0обр(CH3OH). Сколько тепла выделится, если прореагирует 1 г водорода? 4. Напишите термохимическое уравнение, соответствующее табличному значению DH0обр(Cr2O3). Сколько хрома окислилось, если в результате реакции выделилось 11,4 кДж тепла? 5. Напишите термохимическое уравнение, соответствующее табличному значению DH0обр(CH3COOH). Сколько грамм и м3 (н.у.) кислорода пошло на окисление, если выделилось 87,38 кДж тепла? 6. Напишите термохимическое уравнение, соответствующее табличному значению DH0сгор.(С6H6). Сколько тепла выделится, если в реакции участвуют 8 г кислорода? 7. Напишите термохимическое уравнение, соответствующее табличному значению DH0обр(CuSO4). Сколько тепла выделится, если образуется 16 г сульфата меди? 8. Напишите термохимическое уравнение, соответствующее табличному значению DH0обр(SO3.) Сколько тепла выделится, если расходуется 6,4 г серы? 9. Напишите термохимическое уравнение, соответствующее табличному значению DH0обр(FeO). Сколько тепла выделится, если образуется 144 г оксида железа? 10. Напишите термохимическое уравнение, соответствующее табличному значению DH0обр(KOH). Сколько тепла выделится, если образуется 2,8 г едкого кали? 11. На основании табличных данных DH0обр реагентов рассчитать тепловой эффект реакции 2 C(графит) + H2(г) =C2H2(г). Определить к какому типу (экзо- или эндотермическая) она относится. 12. Пользуясь DH0обр реагентов, рассчитать тепловой эффект реакции 3 C2H4(г) = 2CH4(г) + 2 C2H2(г). 13. Найти DH0х.р , пользуясь табличными значениями DH0обр для реакции C2H5OH(ж) = C2H4(г) + H2O(ж). 14. Пользуясь табличными значениями DH0сгор., определить тепловой эффект реакции 6 С(графит) +3 H2(г) = C6H6(ж). Экзо- или эндотермическая это реакция? 15. Рассчитать тепловой эффект реакции C(графит) + 2H2(г) = CH4(г) на основании табличных значений DH0сгор. реагентов. С выделением или поглощением тепла протекает данная реакция? 16. Рассчитать количество выделенного тепла, если в процессе алюмотермии, описываемом уравнением 2 Al(к) + Fe2O3(к) = Al2O3(к) + 2Fe(к), прореагировало 2,7 кг алюминия. Необходимые данные взять из таблицы 1. 17. В основе работы медноокисного гальванического элемента лежит суммарная реакция Zn(к) + CuO(к) = ZnO(к) + Cu(к). Сколько тепла выделится или поглотится, если в реакции участвуют 32,5г цинка? 18. Определить DH0х.р для реакции 2 HCl(г) + Ca(к) = CaCl2(к) + H2(г), пользуясь DH0обр реагентов. Сколько молей HCl вступило в реакцию, если выделилось 171,75 кДж тепла? 19. Уравнение суммарной реакции, протекающей при получении железа в доменной печи: Fe2O3(к) + 1,5 C(кокс) = 1,5 CO2(г) + 2 Fe(к). Найти тепловой эффект реакции, пользуясь табличными значениями DH0обр. Сколько тепла затрачивается на получение 10 кг железа? 20. Пользуясь табличными значениями DH0обр реагентов, найти тепловой эффект реакции 2 Al(к) + Cr2O3(к) =Al2O3(к) + 2Cr(к). Сколько тепла выделилось при образовании 1 г хрома? 21. Сколько тепла поглотится по реакции ZnO(к) + C(графит) = Zn(к) + CO(г), если образуется 1 т цинка? 22. Моноксид углерода СО используют для получения железа из руды по реакции: Fe2O3(к) + 3 CO(г) = 2 Fe(к) + 3 CO2(г), DH0х.р. = -27,43 кДж. Сколько м3 СО необходимо для получения 1 кг железа, какое количество теплоты при этом выделится? 23. DH0сгор. метана СН4 составляет – 890,31 кДж/моль. Почему метан представляет собой лучшее топливо, чем водяной газ (СО + Н2)? Горение водяного газа описывается уравнением CO(г) + H2(г) + O2(г) = CO2(г) + H2O(ж)? Ответ дать на основании расчета. 24. Пользуясь табличными данными DH0обр, рассчитать тепловой эффект реакции получения водяного газа С(графит) + H2O(ж) = CO(г)+ H2(г). Экзо- или эндотермическая это реакция? 25. Вычислить DH0сгор этилена (С2Н4) на основании энтальпии образования реагентов, учитывая, что продуктами реакции являются CO2(г) и H2O(ж). Какое количество тепла выделится при горении 1 л этилена? 26. Какое количество теплоты выделится при сгорании 1л H2S по реакции 2H2S(г) + 3 O2(г) = 2H2O(ж) + 2 SO2(г)? 27. Найти DH0сгор алмаза, если DH0сгор графита = -393,5 кДж/моль, а энтальпия фазового перехода С(графит) → С(алмаз) DH0фп =-1,88 кДж/моль. 28. На основании термохимического расчета DH0х..р. определите экзо- или эндотермической является реакция 3 SiO2(к) + 4 Al(к) = 2 Al2O3(к) + 3 Si(к). 29. Какое количество теплоты, потребуется на разложение 10 кг карбоната натрия по реакции Na2CO3 (к) = Na2O(к) + CO2(г)? 30. Вычислить энтальпию образования HCl(г), если при взаимодействии 1,12 л водорода с хлором выделяется 9,24 кДж тепла. 31. Вычислить энтальпию образования CO2(г), если известно, что при полном сгорании 1 г углерода выделяется 32,8 кДж тепла. 32.Вычислить энтальпию образования FeO, если при взаимодействии 5,6 г железа с кислородом выделяется 26,5 кДж тепла. 33. Какое количество теплоты выделится при переходе 1 кг красного фосфора в черный по реакции P(красный) → P(черный)? DH0обр(Ркрасный) = -18,41 кДж/моль, DH0обр(Рчерный) = -43,2 кДж/моль? 34. При образовании 1 г CCl4 из простых веществ выделяется 0,67 кДж теплоты. Вычислите (DH0обр.)ССl4. 35. При окисления 10,8 г серебра выделилось 1,58 кДж тепла. Найти DH0обр(Ag2O). 36. Пользуясь табличными значениями DH0обр найти DH0х.р для реакции 3Fe(к) + 4 H2O(г) = Fe3O4(к) + 4 H2(г). Определите к какому типу (экзо- или эндотермическая реакция) она относится. 37. На окисление некоторого количества алюминия пошло 10 л (н.у.) кислорода. При этом выделилось 490 кДж тепла. Определить DH0обр (Al2O3). 38. При окислении 10 г кальция выделилось 158,8 кДж тепла. Определить DH0обр(СаО). 39. Вычислить DH0 перехода Н2О(ж)® Н2О(г), на основании следующих термохимических уравнений: Н2(г) + 0,5 О2(г) = Н2О(г) DH0х.р = -241,8 кДж, Н2О(ж) = Н2(г) + 0,5 О2(г) DH0х.р = 286,02 кДж. 40. На основании табличных значений DG0обр реагентов определить возможность самопроизвольного протекания реакции при стандартных условиях. Укажите знак DS0х.р. Ответ обоснуйте. а) С(графит) + СО2(г) = 2СО(г), б) СаСО3(к) = СаО(к) + СО2(г), в) 2NO(г) + O2(г) = 2NO2(г), г) CO(г)+ H2O(г) = CO2(г) + H2(г), д) PCl3(г) + Cl2(г) = PCl5(г), е) 3 Fe(к) + 4 H2O(г) = Fe3O4(к) + 4 H2(г), ж) CH4(г) + I2(г) = CH3I(ж) + HI(г), з) 2 CO(г) + 2 H2(г) = CH4(г) + CO2(г), и) 2 SO2(г) + O2(г) = 2 SO3(г), к) 4 HCl(г) + O2(г) = 2 H2O(г) + 2Cl2(г), л) MgCO3(к) = MgO(к) + CO2(г), м) NH3(г) + HCl(г) = NH4Cl(к), н) SiO2(к) + 2 C(графит) + 2Cl2(г) = SiCl4(ж) + 2CO(г), о) FeO(к) + CO(г) = Fe(к) + CO2(г), п) NH4NO3(к) = N2O(г) + 2 H2O(г), р) MnO2(к) + 2C(графит) = Mn(к) + 2 CO(г), с) Fe2O3(к) + 3 H2(г)= 2 Fe(к) + 3 H2O(г), т) CuS(к) + 2 O2(г)= CuSO4(к), у) 2 PbS(к) + 3 O2(г) = 2 PbO(к) + 2 SO2(г), ф) SiCl4(ж) + 3 H2O(ж) = H2SiO3(к) + 4 HCl(г), х) Al2O3(к) + 3 SO3(г) = Al2(SО4)3(к), ц) PbO(к) + CO(г) = Pb(к) + CO2(г), ч) SiO2(к) + 2 C(графит) = Si(к) + 2 CO(г), ш) COCl2(г) = CO(г) + Cl2(г).
2. Химическая кинетика и равновесие. 41. Равновесие в гетерогенной системе С(графит) + 2 Cl2(г) = CCl4(г) установилось при следующих концентрациях реагирующих веществ (моль/л): [Cl2] = 0,8, [CCl4] =0,3. Рассчитать начальную концентрацию хлора. В каком направлении сместится равновесие в данной системе при увеличении давления? 42. Равновесие в гомогенной системе N2(г) + 3 H2(г) = 2 NH3(г) установилось при следующих концентрациях (моль/л): [N2] = 11; [H2] = 2; [NH3] =3. Вычислить константу равновесия (Кс) и исходные концентрации азота и водорода. В каком направлении сместится равновесие данной реакции при увеличении давления? 43. Равновесие в гомогенной системе 4HCl(г) +O2(г)=2H2O(г)+ 2Cl2(г) установилось при следующих концентрациях (моль/л): [HCl] = 0,25; [O2] =0,3; [H2O] = 0,2; [Cl2] =0,2. Вычислить константу равновесия (Кс) и исходные концентрации HCl и О2. В каком направлении сместится равновесие в данной сиcтеме при уменьшении общего давления? 44. Константа равновесия реакции H2(г) + I2(г) = 2HI(г), DH0х.р.= 51,8 кДж, Кс = 50. Равновесные концентрации водорода и иода (моль/л) соответственно составляют 1 и 6. Рассчитать начальные концентрации водорода и иода. Какие факторы будут способствовать увеличению равновесной концентрации продукта реакции? 45. Для реакции 2NО2(г) = 2NO(г) + O2(г) рассчитать исходную концентрацию NO2 и константу равновесия (Кс), если равновесие установилось при следующих концентрациях (моль/л): [NO2] =0,2; [NO] = 0,6; [O2] = 0,3. В каком направлении сместится равновесие в данной реакции при увеличении давления в системе? Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно. 46. Равновесие в гетерогенной системе С(графит) + СО2(г) = 2 CО(г) установилось при следующих концентрациях реагирующих веществ (моль/л): [CО2] = 0,6, [CO] = 0,4. Вычислить исходную концентрацию СО2 и константу равновесия Кс. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно. 47. Константа равновесия реакции С(графит) + 2 Н2(г) = CН4(г) при некоторой температуре Кс=21,3. Рассчитать исходную концентрацию водорода, если равновесная концентрация метана равна 0,1 моль/л. В каком направлении сместится равновесие в данной системе при уменьшении давления? 48. Исходные концентрации CO и Cl2, участвующих в реакции СО(г) + Cl2(г) = CОCl2(г), равны 1 моль/л . Рассчитать равновесные концентрации реагирующих веществ, если к моменту равновесия прореагировало 60% первоначального количества СО. Записать математическое выражение для Кр и Кс и определить совпадают ли они численно. 49. Разложение метана протекает по уравнению: 2CH4(г) = C2H2(г) + 3H2(г). Рассчитайте исходную концентрацию метана, если равновесие установилось при следующих концентрациях реагирующих веществ (моль/л): [CH4] = 0,2; [H2] = 0,3; [C2H2] = 0,1. В каком направлении сместится равновесие в данной реакции при уменьшении объема системы? Записать математическое выражение для Кр и Кс и определить совпадают ли они численно. 50. Дано уравнение реакции H2(г) + I2(г) = 2 HI(г). Сколько HI образуется к моменту равновесия из 2 моль H2 и 1 моль I2, если Кс = 50. В каком направлении сместится равновесие при увеличении давления в системе? Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно. 51. Реакция разложения диоксида азота протекает по уравнению 2NO2(г) = 2 NO(г) + O2(г). Вычислить равновесные концентрации реагирующих веществ, если исходная концентрация NO2 равна 4 моль/л, а к моменту равновесия прореагировало 60% от его первоначального количества. В каком направлении сместится равновесие в данной реакции при увеличении давления в сиcтеме? Записать математическое выражение для Кр и Кс и определить совпадают ли они численно. 52. Рассчитать константу равновесия (Кс) реакции N2(г) + 3H2(г)= 2NH3(г), если исходные концентрации N2 и H2 соответственно равны 0,4 и 2,24 моль/л и к моменту равновесия прореагировало 20% исходного количества азота. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно. 53. Рассчитать Кс реакции N2O4(г) = 2 NO2(г), если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту равновесия прореагировало 50% N2O4. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно. 54. Константа равновесия (Кс) реакции: СО2(г) + Н2(г) = СО(г) + Н2О(г) при некоторой температуре равна 1. Определить равновесные концентрации реагирующих веществ, если исходные концентрации СО2 и Н2 составляли соответственно 1 и 5 моль/л. Влияете ли изменение давления на смещение равновесия реакции? Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно. 55. Рассчитать Кс реакции 2SO2(г) + O2(г) = 2SO3(г), если начальные концентрации SO2 и O2 (моль/л) соответственно равны 2 и 4 и к моменту равновесия прореагировало 25% исходного количества SO2. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно. 56. Рассчитать Кс реакции CO(г) + Cl2(г) = COCl2(г), если из 2 моль СО и 2 моль Cl2 образовалось к моменту равновесия 0,45 моль COCl2. В каком направлении сместится равновесие в данной реакции при уменьшении объема системы? Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно. 57. Рассчитать Кс реакции 2H2(г) + S2(г) = 2 H2S(г), если исходные концентрации H2 и S2 составляют соответственно 4 и 3 моль/л и к моменту равновесия прореагировало 70% исходного количества Н2. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно. 58. Для реакции H2(г) + Br2(г) = 2 HBr(г) константа равновесия при некоторой температуре Кс=1. Определить равновесные концентрации реагентов, если исходная смесь состояла из 3 молей водорода и 1 моля брома ( общий объем системы 1 л). Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно. 59. Рассчитать константу равновесия (Кс) для реакции PCl5(г) = PCl3(г) + Cl2(г), если к моменту равновесия прореагировало 54% PCl5, исходная концентрация которого составляла 2 моль/л. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно. 60. При некоторой температуре равновесие в системе 2NO2(г) = 2NO(г) + O2(г) установилось при следующих концентрациях: [NO2] = 0,06 моль/л; [NO] = 0,24 моль/л; [O2] = 0,12 моль/л. Найти константу равновесия (Кс) реакции и исходную концентрацию NO2. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно. 61. Константа равновесия (Кс) реакции FeO(к) + CO(г) = Fe(к) + CO2(г) при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если исходная концентрация СО составляла 0,8 моль/л. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно. 62. Рассчитать равновесные концентрации веществ и константу равновесия Кс для реакции С2Н6(г) = С2Н4(г) + Н2(г), если исходная концентрация этана составляла 2 моль/л и к моменту равновесия прореагировало 50% исходного количества. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно. 63. Для реакции 2Fe(к) + 3 H2O(г) = Fe2O3(к) + 3H2(г), DH0х.р. = 35,4 кДж. 1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними; 2) указать, как влияют на концентрацию водорода в равновесной смеси: а) увеличение давления; б) увеличение концентрации водяного пара? 64. Для реакции CaCO3(к) = CO2(г) + CaO(к), DH0х.р. = 277,4 кДж 1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними; 2) Указать, как влияют на концентрацию диоксида углерода в равновесной смеси: а) увеличение температуры; б) уменьшение давления? 65. Для реакции 4HCl(г) + O2(г) = 2 H2O(г) + 2Cl2(г), DH0х.р. = -88 кДж; 1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними; 2) Указать, в каком направлении сместится равновесие при: а) увеличении давления; б) увеличении концентрации водяного пара; в) введении катализатора? 66. Для реакции Ag2O(к) = 2Ag(к) + 0,5O2(г), DH0х.р. = 31,15 кДж 1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними; 2) В сторону расходования или образования кислорода сдвигается равновесие при: а) уменьшении давления; б) увеличении температуры; в) увеличении весового количества Ag2O? 67. Для реакции Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(г), DH0х.р. = -35,4 кДж 1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними; 2) Указать, как влияют на концентрацию водяного пара в равновесной смеси: а) повышение температуры; б) увеличение концентрации водорода; в) введение катализатора. 68. Для реакции C(графит) + CO2(г) = 2CO(г), DH0х.р. = 172,6 кДж 1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними; 2) Указать, как влияет на концентрацию оксида углерода (IV); а) повышение давления; б) увеличение весового количества графита; в) увеличение концентрации оксида углерода (II). 69. Для реакции C(графит) + 2H2(г) = CH4(г), DH0х.р. = -74,86 кДж 1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними; 2) Указать, как влияет на концентрацию метана в равновесной смеси: а) повышение температуры; б) увеличение концентрации водорода; в) введение катализатора. 70. Для реакции С(графит) + О2(г) = СО2(г), DH0х.р. = -393,8 кДж, 1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними; 2) Указать, в каком направлении смещается равновесие в системе при: а) нагревании; б) увеличении весового количества графита; в) увеличении концентрации кислорода. 71. Для реакции синтеза аммиака N2(г) + 3H2(г) = 2NH3(г), DH0х.р. = -92,4 кДж 1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними; 2) В сторону расходования или образования аммиака сдвигается равновесие при: а) увеличении давления; б) увеличении концентрации водорода; в) введении катализатора. 72. Для реакции 2N2O(г) = 2N2(г) + O2(г), DH0х.р. < 0 1) Написать математическое выражение константы равновесия Кс; 2) В сторону расходования или образования кислорода сдвигается равновесие при: а) увеличении температуры; б) уменьшении общего объема смеси; в) увеличении концентрации азота. 73. Для реакции СаО(к) + 3С(графит) = СаС2(к) + СО(г), DH0х.р. < 0 1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними; 2) В сторону расходования или образования СО сдвигается равновесие при: а) введении катализатора; б) увеличении давления; в) понижении температуры. 74. Для реакции BaO(к) + CO2(г) = BaCO3(г), DH0х.р. < 0 1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними; 2) В сторону расходования или образования углекислого газа сдвигается равновесие при: а) увеличении давления; б) повышении температуры. 75. Для реакции Fe(к) + 0,5 O2(г) = FeO(к), DH0х.р. < 0 1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними; 2) В сторону расходования или образования кислорода сдвигается равновесие при: а) увеличении общего объема системы; б) понижении температуры. 76. Для реакции SO2Cl2(г) = SO2(г) + Cl2(г) DH0х.р. > 0 1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними; 2) В сторону расходования или образования хлора сдвигается равновесие при: а) увеличении концентрации диоксида серы; б) увеличении температуры; в) введении катализатора.
3. Равновесие в растворах электролитов 3.1 Реакции ионного обмена 77. Будут ли протекать реакции между растворами следующих электролитов: 1) K2CO3 и HCl; 2) KNO3 и Na2S; 3) CdSO4 и NaOH? Написать молекулярные и ионно-молекулярные уравнения возможных реакций. 78. С помощью молекулярных и ионно-молекулярных уравнений ответить на вопрос: при смешении растворов каких солей можно получить в осадке карбонат кальция? 79. Будут ли протекать реакции между растворами следующих электролитов: Ba(OH)2 и HNO3; 2) (NH4)2SO4 и KOH; 3) CuSO4 и NaOH? Написать молекулярные и ионно-молекулярные уравнения возможных реакций. 80. С помощью молекулярных и ионно-молекулярных уравнений ответить на вопрос: растворы каких солей надо смешать для получения в осадке сульфата бария? 81. Написать молекулярные и ионно-молекулярные уравнения реакций между растворами следующих электролитов: 1) сульфита натрия и серной кислоты; 2) хлорида цинка и гидроксида натрия; 3) карбоната калия и соляной кислоты. 82. Написать молекулярные и ионно-молекулярные уравнения реакций: 1) растворения сульфида железа (II) в соляной кислоте; 2) взаимодействия сульфата кадмия и гидроксида натрия; 3) растворения гидроксида алюминия в избытке раствора щелочи. 83. Можно ли приготовить раствор, содержащий одновременно следующие пары веществ: 1) CuSO4 и NaNO3; 2) Na2CO3 и HCl; 3) AgNO3 и NaCl? Ответ обосновать с помощью молекулярных и ионно-молекулярных уравнений. 84. Смешивают попарно растворы: 1) NaOH и HNO3; 2) K2CO3 и HCl; 3) CuSO4 и KOH. В каких случаях протекают реакции? Составить их молекулярные и ионно-молекулярные уравнения. 85. Написать уравнения реакций между растворами следующих электролитов: 1) К2CO3 и НСl; 2) AgNO3 и K2CrO4; 3) Zn(OH)2 и KOH(избыток). 86. Будут ли протекать реакции между растворами следующих электролитов: Na2SO4 и BaCl2; 2) NaHCO3 и NaOH; 3) Pb(NO3)2 и KOH? Написать молекулярные и ионно-молекулярные уравнения возможных реакций. 87. Смешивают попарно растворы следующих электролитов: 1) NaOH и HCl; 2) K2SО3 и HCl; 3) H2SO4 и CH3COONa. Какие из реакций протекают практически до конца? Составить молекулярные и ионно-молекулярные уравнения соответствующих реакций. 88. Составить молекулярные и ионно-молекулярные уравнения реакций, происходящих в растворах между: 1) сероводородом и сульфатом никеля (II); 2) гидрокарбонатом и гидроксидом калия; 3) хлоридом аммония и гидроксидом калия. 89. Написать молекулярные и ионно-молекулярные уравнения реакций нейтрализации: 1) HCl + Ba(OH)2; 2) Fe(OH)2 + HNO3; 3) H2S + NaOH. Указать какие из этих реакций протекают обратимо. 90. Написать молекулярные и ионно-молекулярные уравнения реакций, протекающих в растворах между: 1) Na2SO3 и HCl; 2) Cr2(SO4)3 и KOH; 3) Na2CrO4 и AgNO3. Указать в каждом случае соединение, образование которого вызывает смещение равновесия. 91. Составить молекулярные уравнения к следующим ионно-молекулярным уравнениям:
3.2 Ионное произведение воды. Водородный показатель. 92. Рассчитать рН 0,001 М раствора NaOH. 93. Рассчитать рН 0,18 М раствора NH4OH, если Кд = 1,8´10-5. 94. Как изменится рН чистой воды, если к 1 л ее прибавить 0,01 моль H2SO4? 95. Определить рН и концентрацию гидроксид-ионов (моль/л) в 0,1 М растворе HCl. 96. Определить степень диссоциации уксусной кислоты CH3COOH, рН которого равен 3. Кд = 1,8´10-5. 97. Как изменится рН чистой воды, если к 1 л ее добавить 0,001 моль NaOH? 98. Вычислить молярность раствора щелочи, рН которого равен 12. 99. Определить рН 0,01 М раствора HCN, Кд = 7,9´10-10 100. Определить молярную концентрацию и рН раствора HCl, если концентрация гидроксид-ионов равна 10-14 моль/л. 101. Какова концентрация гидроксид-ионов в растворах, рН которых 9, 7, 4? Какую реакцию среды имеют эти растворы? 102. Концентрация гидроксид-ионов в растворе КОН равна 10-2 моль/л. Определить рН и молярность данного раствора. 103. Определить рН и концентрацию гидроксид-ионов (моль/л) 0,1М H2S раствора , учитывая только первую ступень диссоциации, для которой Кд = 6.10-8. 104. Определить молярность и рН раствора HCN, если концентрация гидроксид-ионов в нем составляет 10-9 моль/ л. Кд = 7,9´10-10. 105. Вычислить степень диссоциации и рН 0,1М раствора HNO2. Кд = 5´10-4. 106. Рассчитать молярность раствора NH4OH, рН которого равен 11. Кд = 1,8´10-5. 107. Чему равен рН растворов сильных электролитов (α=1) KCl, HCl, KOH, концентрация которых равна 0,01М? 108. Определить молярность и концентрацию гидроксид-ионов (моль/л) раствора HNO2, рН которого равен 4. Кд = 5´10-4. 109. рН раствора H2SO4 равен 6. Рассчитать молярность раствора и концентрацию гидроксид-ионов в данном растворе. 110. В каком из растворов, 0,01 М NaOH или 0,01 М NH4OH (Кд = 1.8´10-5), щелочность среды больше? Ответ подтвердите расчетом рН.
3.3 Растворимость и произведение растворимости 111. Определить растворимость в моль/л и г/л следующих труднорастворимых соединений:
112.Образуется ли осадок труднорастворимого соединения при смешивании равных объемов растворов следующих электролитов указанной концентрации:
113. Можно ли приготовить растворы следующих электролитов с указанными концентрациями (моль/л)? Ответ дать на основании ПР.
Варианты домашних заданий
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||