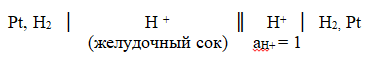| Общая информация » Каталог студенческих работ » ЕСТЕСТВЕННЫЕ ДИСЦИПЛИНЫ » Физическая и коллоидная химия |
| 24.11.2017, 20:20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ ПО ФИЗИЧЕСКОЙ ХИМИИ 1. Что изучает классическая термодинамика? Предмет и задачи химической термодинамики. 2. Охарактеризуйте термодинамическую систему. Рассмотрите различные типы систем, приведите примеры. 3. Состояние системы. Основные параметры состояния и функции основных параметров состояния. Экстенсивные и интенсивные свойства. 4. Дайте понятие термодинамического процесса. Самопроизвольные и несамопроизвольные, равновесные и неравновесные, обратимые и необратимые процессы. Примеры. 5. Внутренняя энергия и энтальпия как функции состояния. Что они характеризуют и чем отличаются друг от друга? 6. Сущность теплоты и работы. В чем сходство и различие между ними? 7. Формулировки I закона термодинамики и его математическое выражение. 8. Рассмотрите приложение I закона термодинамики к различным термодинамическим процессам (изохорным, изобарным, изотермическим, адиабатическим). 9. Дайте понятие теплового эффекта химической реакции. Закон Гесса, его практическое применение. 10.Тепловой эффект химической реакции при стандартных условиях. Стандартные теплоты образования и стандартные теплоты сгорания. Расчет теплового эффекта реакции по стандартным теплотам образования и стандартным теплотам сгорания. 11.Понятие о теплоемкости. Различные виды теплоемкости (истинная, молярная, средняя, изобарная, изохорная). 12.Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгофа. 13.Дайте качественную оценку зависимости теплового эффекта реакции от температуры, используя дифференциальную форму уравнения Кирхгофа для изобарного процесса. 14.Применение уравнения Кирхгофа (интегральная форма) для расчета теплового эффекта реакции при любой температуре. 15.Приведите формулировки второго закона термодинамики. КПД тепловой машины. 16.Энтропия, ее физический смысл. Математическое выражение второго закона термодинамики через энтропию для обратимых и необратимых процессов. Выражение, объединяющее I и II законы термодинамики. 17.Постулат Планка. Абсолютная и стандартная энтропия. 18.Вывод формулы для расчета энтропии при любой температуре через абсолютную и стандартную энтропию. 19.Изменение энтропии при фазовых переходах, изобарных, изохорных процессах и при химических реакциях. 20.Энтропия и термодинамическая вероятность. Статистический характер второго закона термодинамики. Уравнение Больцмана. 21.Энтропия как критерий самопроизвольного протекания процессов в изолированной системе. Определите качественно, будет ли протекать реакция N2 + 3H2 ↔ 2NH3 в изолированной системе? 22.Свободная энергия Гельмгольца, ее физический смысл. 23.Свободная энергия Гиббса, ее физический смысл. 24.Энергия Гельмгольца как критерий самопроизвольного протекания процессов при Т = const и V = const. 25.Энергия Гиббса как критерий самопроизвольного протекания процессов при Т = const и Р = const. 26.Стандартные энергии Гиббса и Гельмгольца. Как можно рассчитать изменение свободной энергии Гиббса при стандартных условиях? 27.Расчет изменения свободной энергии Гиббса при температуре, отличной от стандартной? 28.Химический потенциал: определение, математическое выражение, физический смысл. 29.Применение химических потенциалов для расчета изменений свободной энергии Гельмгольца и свободной энергии Гиббса. 30.Выражение для химического потенциала идеального и реального газа, реального раствора. Понятие фугитивности и активности. 31.Закон действующих масс. Запишите выражение константы химического равновесия для конкретных реакций разными способами. Какая связь между Кс и Кр? 32.Уравнение изотермы химической реакции, анализ уравнения. Для чего используют это уравнение? 33.Связь константы равновесия реакции со стандартной свободной энергией Гиббса и стандартной свободной энергией Гельмгольца. 34.Расчет константы равновесия реакции по стандартным термодинамическим величинам. Приведите конкретный пример. 35.Как зависит константа химического равновесия от температуры? Уравнения изохоры и изобары реакции. 36.Особенности химического равновесия в гетерогенных системах. Покажите на конкретных примерах. 37.Фаза, виды фаз, примеры. Фазовые переходы, условия фазового равновесия. 38.Что такое компонент? Чему равно число независимых компонентов в системах при взаимодействии компонентов между собой и без взаимодействия? Приведите примеры. 39.Что такое число степеней свободы? Приведите примеры систем с различным числом степеней свободы. 40.Правило фаз Гиббса. Приведите примеры расчета по правилу фаз. 41.Уравнение Клапейрона-Клаузиуса. Как меняется температура плавления веществ с изменением давления? 42.Интегрирование уравнения Клапейрона-Клаузиуса, применение его к процессам испарения. 43.Диаграммы состояния в физико-химическом методе анализа систем. Принцип непрерывности, принцип соответствия. 44.Анализ диаграммы состояния воды. Рассчитайте вариантность этой системы в фигуративных точках, лежащих на линиях, в областях, в тройной точке. 45.Термический анализ. Кривые охлаждения системы, компоненты которой не растворимы в твердом состоянии, а в жидком - растворяются неограниченно. 46.Построение диаграммы плавкости двухкомпонентной системы с простой эвтектикой по кривым охлаждения. Анализ полученной диаграммы. 47.Применение правила фаз и правила рычага к диаграмме плавкости (приведите несколько примеров). 48.Приведите кривые охлаждения чистого компонента и смесей различного состава. Объясните ход этих кривых. 49.Анализ диаграммы плавкости двухкомпонентной системы с образованием химического соединения. Укажите состав и рассчитайте число степеней свободы для эвтектических точек. 50.Используя диаграмму плавкости с образованием химического соединения, проанализируйте процесс нагревания смеси любого состава от твердого до жидкого состояния. 51.Применение диаграмм плавкости в фармации (улучшение качества лекарств, избежание несовместимости компонентов лекарств). 52.Определение состава неизвестных смесей по диаграмме плавкости. Приведите 2 – 3 примера. 53.Диаграмма растворимости ограниченно растворимых жидкостей с верхней критической температурой, анализ диаграммы. 54.Диаграмма растворимости ограниченно растворимых жидкостей с нижней критической температурой, анализ диаграммы. 55.Диаграмма растворимости ограниченно растворимых жидкостей с замкнутой областью расслоения, анализ диаграммы. 56.Определение состава равновесных фаз и расчет числа степеней свободы по диаграммам растворимости ограниченно растворимых жидкостей. 57.Закон распределения. Коэффициент распределения, влияние на него различных факторов, практическое применение в фармации. 58.Расчет коэффициента распределения при явлениях диссоциации и ассоциации растворенного вещества. 59.Процесс экстракции, оптимальные условия экстрагирования. 60.Покажите, что дробная экстракция эффективнее однократной. Применение экстрагирования в фармации. 61.Современные представления о природе растворов и механизме растворения. Теории растворов. 62.Термодинамические и молекулярно-кинетические условия образования растворов. Биологическая значимость растворов. 63.Способы выражения концентрации растворов (молярная, объемная, массовая доли; молярная и моляльная концентрации; молярная концентрация эквивалента). 64.Разбавленные растворы неэлектролитов. Давление насыщенного пара чистого растворителя. Понижение давления насыщенного пара растворителя над раствором нелетучего вещества. Закон Рауля. 65.Эбуллиоскопическое следствие закона Рауля, его графическая интерпритация. 66.Криоскопическое следствие закона Рауля, его графическая интерпретация. 67.Осмос и осмотическое давление. Уравнение Вант-Гоффа. 68.Значение осмоса для живых организмов и растений. Осмомолярная концентрация, определение осмомолярной концентрации. Изотонические, гипертонические, гипотонические растворы. Онкотическое давление крови, лизис, плазмолиз. 69.Закон Рауля для растворов электролитов. Изотонический и осмотический коэффициенты, связь между степенью электролитической диссоциации и изотоническим коэффициентом. 70.Влияние концентрации раствора электролита на температуру кипения раствора. 71.Влияние концентрации раствора электролита на температуру кристаллизации раствора. 72.Уравнение Вант-Гоффа для растворов электролитов. Определение осмотического давления, осмотической концентрации, молярной массы растворенного вещества осмотическим методом. 73.Определение молярной массы растворенного вещества криоскопическим и эбулиоскопическим методами. 74.Идеальные растворы жидкостей в жидкостях. Закон Рауля для идеальных растворов. Приведите график зависимость общего и парциального давления паров компонентов от состава идеального раствора. Примеры идеальных растворов. 75.Положительные и отрицательные отклонения от закона Рауля, их причины. Приведите графическую зависимость общего и парциального давления паров компонентов от состава неидеального раствора. Для каких систем характерны эти отклонения? 76.Для двух неограниченно растворимых жидкостей, подчиняющихся закону Рауля, приведите диаграмму зависимости давления насыщенного пара от состава, проанализируйте ее, рассчитайте число степеней свободы во всех областях диаграммы. 77.На примере двух неограниченно растворимых жидкостей, подчиняющихся закону Рауля, приведите диаграмму кипения, проанализируйте ее, рассчитайте число степеней свободы в гомогенной и гетерогенной областях диаграммы. 78.Для двух неограниченно растворимых жидкостей, с положительным отклонением от закона Рауля, приведите диаграмму температура кипения - состав, проанализируйте ее, примените правило рычага для любой выбранной точки в гетерогенной области. 79.Для двух неограниченно растворимых жидкостей, с отрицательным отклонением от закона Рауля, приведите диаграмму кипения, рассчитайте число степеней свободы в гомогенной и гетерогенной областях диаграммы, определите состав пара и жидкости для любой выбранной точки гетерогенной области. 80.Анализ диаграмм зависимости давления насыщенного пара от состава и диаграмм кипения для двух неограниченно растворимых жидкостей, подчиняющихся закону Рауля. I закон Коновалова. 81.Приведите диаграммы кипения двух неограниченно растворимых жидкостей, не подчиняющихся закону Рауля, с максимумом или минимумом на кривых общего давления, сформулируйте II закон Коновалова. 82.Что собой представляют азеотропные растворы? Приведите примеры азеотропов с минимальной и максимальной температурами кипения. 83.Простая перегонка двух неограниченно растворимых жидкостей, подчиняющихся закону Рауля. 84.Фракционная перегонка, возможности использования. 85.Ректификация. Устройство и принцип действия ректификационных колонн. 86.Простая перегонка двух неограниченно растворимых жидкостей с положительными и отрицательными отклонениями от закона Рауля. 87.Ректификация азеотропных смесей с максимальной температурой кипения. Какие компоненты можно получить в результате перегонки? 88.Ректификация азеотропных смесей с минимальной температурой кипения. Какие компоненты можно получить в результате перегонки? 89.Как можно разделить азеотропные смеси на чистые компоненты? 90.Перегонка с водяным паром, расходный коэффициент пара. Какие вещества можно перегонять с водяным паром? Применение в фармации. 91. Что такое кондуктометрия? Для каких целей используется этот метод в медико-биологических исследованиях? Прямые и косвенные методы кондуктометрии. 92. Проводники II рода. Удельная электрическая проводимость, ее зависимость от концентрации для сильных и слабых электролитов, единицы измерения. 93. Молярная электрическая проводимость, ее зависимость от концентрации для сильных и слабых электролитов, единицы измерения. Как связаны между собой удельная и молярная электрические проводимости? 94. Закон Кольрауша о независимости движения ионов. Как предельная молярная электропроводимость ионов связана с их электрической подвижностью? 95. Вывод закона разведения Оствальда для одно-одновалентного электролита. 96. Определение степени и константы ионизации слабого электролита через данные кондуктометрических измерений. 97. Рассмотрите основные элементы установки для кондуктометрического титрования и принцип работы. В каких случаях этот метод можно использовать, его преимущества? 98. Кондуктометрическое титрование. Приведите примеры кондуктометрического титрования: а) сильной кислоты сильным основанием; б) смеси слабой и сильной кислот сильным основанием; Приведите кривые титрования и объясните их ход. 99. Приведите кривые кондуктометрического титрования: а) слабой кислоты сильным основанием; б) смеси слабой и сильной кислот сильным основанием. 100. Какие потенциалы возникают на границах раздела следующих фаз: а) металл1 – металл2 б) раствор1 – раствор2 Разберите на конкретных примерах. 101. Механизм возникновения скачка потенциала на границе металл – раствор. Разберите на конкретном примере. 102. Электроды первого рода. Что характерно для данного типа электродов? Приведите конкретные примеры. 103. Электроды второго рода. Покажите, что электроды второго рода обратимы относительно катиона и аниона одновременно. 104. Окислительно-восстановительные электроды I и II типа. Как возникает потенциал у данного типа электродов? Стандартный окислительно-восстановительный потенциал. 105. Ионоселективные электроды. Какова особенность данного типа электродов? Стеклянный электрод. 106. Устройство водородного электрода. Стандартные потенциалы по водородной шкале, их определение, покажите на конкретных примерах. 107. Какие гальванические элементы называются химическими? Устройство и работа гальванического элемента (разберите на конкретном примере). Электродвижущая сила гальванического элемента. 108. Какие элементы называются концентрационными? Типы концентрационных элементов. Приведите конкретные примеры. 109. Какие физико-химические величины можно рассчитать, измеряя ЭДС гальванического элемента? 110. Как можно рассчитать тепловой эффект и константу равновесия реакции, протекающей в гальваническом элементе? Какие экспериментальные данные для этого необходимы? 111. Обратимые и необратимые электроды. Классификация обратимых электродов. Приведите конкретные примеры. 112. Классификация электрохимических цепей. За счет чего получается электрическая энергия в электрохимических цепях? Приведите конкретные примеры. 113. Что такое потенциометрия? Прямые и косвенные потенциометрические методы. 114. Определение рН раствора потенциометрическим методом. Разберите на конкретных примерах, приведите схемы гальванических элементов. 115. Потенциометрическое титрование. Как определяется положение эквивалентной точки по кривым титрования? Какие приборы используются при потенциометрическом титровании? Интегральная и дифференциальная кривые титрования. 116. Правила схематического изображения электродов и гальванического элемента. Разберите на конкретных примерах. 117. Диффузионный потенциал. Цепи с переносом и без переноса ионов. Приведите конкретные примеры. Как можно составить гальваническую цепь, чтобы диффузионный потенциал был равен нулю. 118. Сравните хингидронный и стеклянный электроды как индикаторные электроды для измерения рН, укажите их достоинства и недостатки. Запишите схемы гальванических элементов, с помощью которых можно измерить рН раствора. 119. Какие электроды можно использовать в качестве индикаторных при потенциометрическом титровании кислот? Дайте развернутый ответ, приведите конкретные гальванические элементы. 120. Кислотно-основное потенциометрическое титрование (выбор электродов, составление гальванических цепей, кривые титрования). 121. Химическая кинетика: определение, теоретическое и прикладное значение. 122. Скорость химической реакции. Факторы, влияющие на скорость химической реакции. Экспериментальное определение скорости химической реакции. 123. Закон действующих масс для скорости химической реакции (элементарных и сложных реакций). Физический смысл константы скорости химической реакции. Приведите примеры записи закона для различных реакций. 124. Элементарный акт химической реакции. Молекулярность и порядок реакции. Классификация реакций по этим признакам. 125. Причины несовпадения порядка и молекулярности реакции. Приведите примеры. 126. Кинетическое уравнение реакции первого порядка: вывод и анализ. Примеры реакций первого порядка. 127. Кинетическое уравнение реакций второго порядка при равных исходных концентрациях: вывод и анализ. Примеры реакций второго порядка. 128. Реакции нулевого порядка; кинетические закономерности, примеры. 129. Графическое определение констант скоростей химических реакций нулевого, первого и второго (при равных исходных концентрациях) порядков. 130. Что такое время (период) полупревращения и как оно связано с константой скорости реакции первого и второго порядков? 131. Методы определения порядка реакции: подстановки, графический, изоляции или избытка. 132. Различный характер зависимости периода полупревращения от начальной концентрации в реакциях различного порядка. Определение порядка реакции по периоду полупревращения. 133. Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Особенности биохимических реакций. 134. Уравнение Аррениуса.Графический способ определения коэффициентов в уравнении Аррениуса. 135. Понятие об энергии активации. Соотношение между энергией активации прямой и обратной реакции и изменением внутренней энергии системы. 136. Экспериментальное определение энергии активации. Графический и аналитический метод. 137. Срок годности лекарственного препарата. Ускоренные методы определения срока годности лекарств. 138. Основы теории активных соударений. Энергия активации и стерический фактор в теории столкновений. 139. Основы теории активированного комплекса. Энтропия и энергия активации в теории активированного комплекса. 140. Сложные реакции: обратимые, последовательные, параллельные, сопряженные. Приведите примеры. 141. Параллельные реакции. Кинетическое уравнение параллельных реакций первого порядка и его анализ. Приведите примеры. 142. Сопряженные реакции. Особенность механизма сопряженных реакций. Приведите примеры. 143. Обратимые реакции. Кинетическое уравнение обратимой реакции первого порядка и его анализ. 144. Последовательные реакции. Лимитирующая стадия последовательных реакций. Приведите примеры. 145. Цепные реакции. Стадии цепной реакции. Неразветвленные и разветвленные цепные реакции. 146. Природа фотохимических реакций. Основные законы фотолиза. Квантовый выход. Практически важные фотохимические реакции. 147. Основные понятия катализа. Гомогенный и гетерогенный катализ. Влияние катализатора на энергию активации реакции. 148. Механизм действия катализаторов. Активность, селективность катализатора. 149. Ферментативный катализ. Примеры ферментов. Факторы, влияющие на активность ферментов. 150. Основы теории гетерогенного катализа А.А. Баландина (мультиплетная теория катализа). Теория активных ансамблей катализа Н.И.Кобозева.
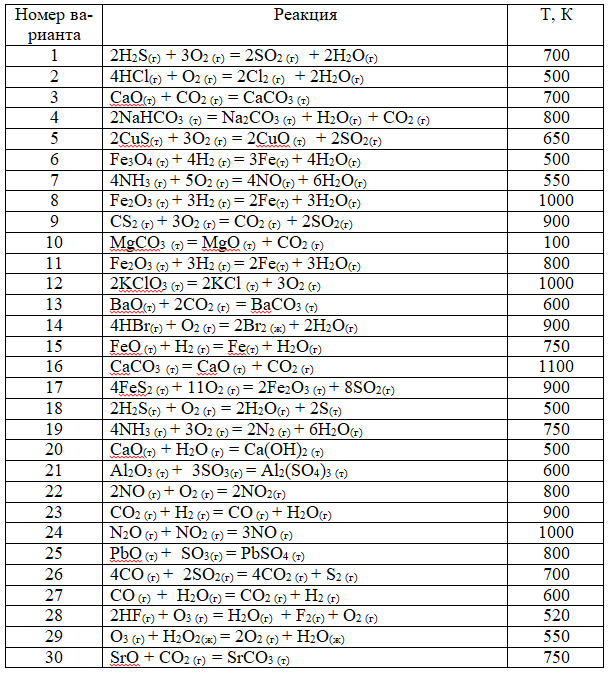
ЗАДАЧИ ПО ФИЗИЧЕСКОЙ ХИМИИ (1 – 30). Определите возможность протекания реакции при стандартных условиях, а также при температуре, указанной в таблице: ∆fН°298 и S°298 соответствующих веществ даны в таблице (см. приложение)
31-33. Константа химического равновесия реакции С2Н6(г) С2Н4(г) + Н2(г) при 1500 К равна 40. Определите направление реакции, если в начале реакции парциальные давления компонентов имеют следующие значения:
34-37. Константа равновесия реакции Н2 + I2 2HI при 693 К равна 50. Образуется ли йодоводород при исходных концентрациях компонентов, приведенных в таблице? Вещества в реакционной сосуд поступают из бесконечно больших емкостей. Йодоводород выводится из реакционного сосуда в емкость бесконечно большого объема.
38. Свободная энергия Гиббса химической реакции (в газовой фазе) СО + Н2О СО2 + Н2 при 373 К равна -30 кДж/моль. Определите константу равновесия реакции. 39. Для реакции PCl3 + Cl2 PCl5 при 500 К Кр=2,962·10-5 Па-1. Будет ли происходить образование PCl5 в газовой смеси, содержащей PCl3, Cl2 и PCl5, если парциальные давления реагирующих веществ имеют следующие значения: Р(PCl3) = 1,013·104 Па, Р(PCl5) = 5,07·104 Па, Р(Cl2) = 2,026·105 Па. 40. Для получения SO3 смесь газов SO2 и О2 медленно пропускают через трубку с платиновым катализатором при 1000 К. Парциальные давления выходящих из трубки газов следующие: Р(SO2) = 0,55 атм.; Р(О2) = 0,101 атм.; Р(SO3) = 0,331 атм. а) Рассчитайте константу равновесия Кр для этой реакции при 1000 К. б) Определите каким должно быть парциальное давление кислорода при 1000 К, чтобы в условиях равновесия парциальные давления SO2 и SO3 были одинаковыми. 41-42. Для реакции 2FeO(т) 2Fe(т) + О2(г) при 1000 К Кр = 3,14·10-3 Па. Определите в каком направлении пойдет процесс при следующих значениях парциального давления кислорода над смесью FeO и Fe.
43. 0,02М раствор пикриновой кислоты в Н2О находится в равновесии с 0,07М раствором ее в бензоле. Вычислите коэффициент распределения пикриновой кислоты между бензолом и водой. В бензольном растворе кислота находится в виде простых молекул, а в воде частично диссоциирована (α = 0,9). 44. Какую массу органического вещества (М. 90 у.е.) можно извлечь хлороформом из 200 мл 0,5М водного раствора, если экстрагирование проводить двукратно порциями по 50 мл? Коэффициент распределения органического вещества между хлороформом и водой при 20°С равен 15. 45. В водном растворе хлорид ртути образует двойные молекулы Hg2Cl2, а в бензоле он находится в виде простых молекул. Рассчитайте коэффициент распределения хлорида ртути между бензолом и водой при 25°С по следующим данным:
46-53. Рассчитайте число степеней свободы в системах. Поясните полученный результат.
54. Молярный объем некоторого вещества при давлении 1·105 Па и температуре плавления 427 К равен 142·10-6 м3/моль. Молярный объем жидкости при этих же условиях равен 152·10-6 м3/моль. При возрастании давления до 1,2·106 Па температура плавления увеличивается до 429 К. Рассчитайте энтальпию и энтропию плавления этого вещества. 55. При каком давлении вода будет кипеть при 95°С? Теплота испарения воды 40,6 кДж/моль. 56. При температуре 10°С давление паров эфира равно 292 мм рт.ст., а при 20°С -442,5 мм рт.ст. Определите теплоту испарения эфира. 57. До какого значения надо повысить давление, чтобы температура кипения некоторого вещества повысилась до 500 К? В нормальных условиях оно кипит при 450 К, а его молярная теплота испарения 50 кДж/моль. 58-60. Постройте диаграмму плавкости системы с простой эвтектикой для веществ А (tпл 150°С) и В (tпл 100°С). Состав эвтектической смеси 60% А и 40% В, температура ее плавления 50°С. Линии ликвидуса изобразите прямыми линиями. С помощью диаграммы выполните следующие задания:
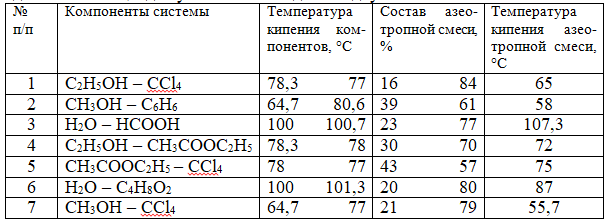
При решении задач 61-69 при построении диаграмм кипения используйте данные таблицы для указанных в заданиях двухкомпонентных систем:
61. Постройте диаграмму кипения для смеси №1 и определите результат фракционной перегонки раствора, содержащего 90% СCl4 и 10% С2Н5ОН. 62. Постройте диаграмму кипения для смеси №1 и определите результат фракционной перегонки раствора, содержащего 10% СCl4 и 90% С2Н5ОН. 63. Постройте диаграмму кипения для смеси №2 и определите результат фракционной перегонки раствора, содержащего 60% СН3ОН и 40% С6Н6. 64. Постройте диаграмму кипения для смеси №2 и определите результат фракционной перегонки раствора, содержащего 70% С6Н6 и 30% СН3ОН. 65. Постройте диаграмму кипения для смеси №3, определите число степеней свободы в гетерогенной области. Какой компонент можно получить в чистом виде при фракционной перегонке раствора, содержащего 80% НСООН и 20% Н2О. 66. Постройте диаграмму кипения для смеси №4 и определите результат фракционной перегонки раствора, содержащего 20% СН3СООС2Н5 и 80% С2Н5ОН. 67. Постройте диаграмму кипения для смеси №5, определите результат фракционной перегонки раствора, содержащего 30% СН3СООС2Н5 и 70% СCl4. 68. Постройте диаграмму кипения для смеси №6, определите число степеней свободы в точке кипения азеотропной смеси и определите результат фракционной перегонки раствора, содержащего 50% Н2О и 50% С4Н8О2. 69. Постройте диаграмму кипения для смеси №7, укажите фазовое состояние системы во всех областях диаграммы. Определите состав равновесного пара раствора, содержащего 40% СCl4 и 60% СН3ОН. 70. Какую массу глицерина С3Н8О3 надо растворить в 100 г воды при 30°С, чтобы понизить давление пара на 300 Н/м2, если давление пара воды при 30°С составляет 4242 Н/м2? 71. Вычислите давление насыщенного пара над раствором, содержащим 110 г глицерина С3Н8О3 и 401 г воды при 40°С. Давление паров чистой воды при данной температуре 7,3759 кПа. 72. Равновесное давление пара над раствором, содержащим 13 г нелетучего вещества в 100 г воды при 30°С равно 3,65 кПа. Рассчитайте молярную массу растворенного вещества, полагая, что раствор идеален. Давление насыщенных паров чистой воды при данной температуре равно 3,74 кПа. 73. Чему равно давление насыщенного пара над раствором, содержащим 10 г мочевины (NH2)2СО в 200 г воды при 25°С, если давление паров чистой воды при данной температуре равно 3,1672 кПа? 74. В 1000 г Н2О растворено 68,4 г сахарозы С12Н22О11. Рассчитайте температуры замерзания и кипения раствора, давление пара над раствором при 20°С, если давление чистых паров воды при 20°С составляет 2314,9 Па. К(Н2О) = 1,86 К·кг/моль, Е(Н2О) = 0,52 К·кг/моль. 75. Раствор, содержащий 0,81 г углеводорода Н(СН2)nН в 190 г C2H5Br замерзает при 9,47°С. Температура замерзания C2H5Br 10°С, К(C2H5Br) = 12,5 К·кг/моль. Рассчитайте молярную массу вещества и приведите формулу. 76. 1,263 г нелетучей жирной кислоты общей формулы СnН2n-3СООН растворено в 500 г CCl4. Температура кипения раствора составила 76,804°С. Определите, какая кислота была исследована, если tкип CCl4 = 76,76°С, а эбулиоскопическая постоянная CCl4 4,88 К·кг/моль. 77. Раствор, приготовленный из 0,524 г сахарозы С12Н22О11 и 75 г воды, замерзает при температуре, которая ниже температуры замерзания воды на 0,038 К. Определите криоскопическую постоянную воды. 78. В радиатор автомобиля налили 9 л воды и 2 л метилового спирта (ρ(СН3ОН) = 800 кг/м3). При какой минимальной температуре можно оставить автомобиль на открытом воздухе, не боясь, что вода в радиаторе замерзнет, если К(Н2О) = 1,86 К·кг/моль. 79. Водный раствор С2Н5ОН, содержащий 8,74 г спирта на 1000 г воды, замерзает при -0,354°С. Определите молярную массу спирта в растворе, приняв его идеальным. Криоскопическая постоянная Н2О равна 1,86 К·кг/моль. 80. При 18°С осмотическое давление раствора глицерина равно 3·105 Па. Как изменится осмотическое давление, если раствор разбавить в 3 раза, а температуру повысить до 37°С? 81. Осмотическое давление 0,025М раствора электролита равно 1,36·10-5 Па при 0°С. Кажущаяся степень диссоциации электролита 70%. На сколько ионов диссоциирует молекула электролита? 82. Понижение температуры замерзания водного раствора исследуемого вещества составляет 1,395 К, а бензольного 1,28 К. Чем объяснятся различие в ∆Т, если моляльности растворов одинаковы? Рассчитайте изотонический коэффициент, если К(С6Н6) = 5,16 К·кг/моль, а К(Н2О) = 1,86 К·кг/моль. 83. При растворении 2,05 г NaOH в 100 г воды температура кипения повысилась на 0,496°С. Определите кажущуюся степень диссоциации NaOH в растворе, если эбулиоскопическая постоянная воды равна 0,52 К·кг/моль. 84. Раствор, содержащий 1,23 г бромида натрия в 40 г воды замерзает при температуре -0,95°С. Вычислите кажущуюся степень диссоциации бромида натрия в этом растворе, если К(Н2О) = 1,86 К·кг/моль. 85. Раствор, объемом 1 л, содержащий 0,87 моль тростникового сахара при 18°С изоосмотичен 1 л раствора, содержащего 0,5 моль NaCl. Определите кажущуюся степень диссоциации и изотонический коэффициент для раствора хлорида натрия. 86. Определите концентрацию водного раствора глюкозы, если этот раствор при 291 К изоосмотичен раствору, содержащему 0,5·103 моль/м3 CaCl2, причем кажущаяся степень диссоциации последнего при указанной температуре составляет 65,4%. 87. Для очистки толуола его перегоняют с водяным паром при температуре 358 К. Определите расход водяного пара на перегонку 1 кг толуола С6Н5СН3, если давление насыщенного пара воды при 358 К составляет 6,2·104 Па, а для толуола 4,8·104 Па. 88. При перегонке бромбензола с водяным паром кипение начинается при 368,3 К. Бромбензол практически нерастворим в воде, а парциальные давления паров воды и бромбензола при указанной температуре равны 8,519·104 Па и 1,613·104 Па соответственно. Вычислите массу бромбензола, которая переходит в дистиллят совместно с 1 кг Н2О и рассчитайте общее давление над системой при 368,3 К. 89. Давление пара над системой из двух несмешивающихся жидкостей анилин-вода равно 9,999·104 Па при 371 К. Давление пара воды при этой температуре равно 9,426·104 Па. Какую массу воды необходимо взять для перегонки с водяным паром 1 кг анилина при внешнем давлении 9,999·104 Па? 90. Давление насыщенного пара над системой из двух несмешивающихся жидкостей диэтиланилин-вода равно 10,133·104 Па при 372 К. Какая масса пара воды потребуется для перегонки 0,1 кг диэтиланилина, если давление пара воды при указанной температуре 9,919·104 Па? 91. Молярная электрическая проводимость водного раствора уксусной кислоты при 25°С равна 4,815·10-3 См·м2/моль при концентрации 1,02 ммоль/л и 39,06·10-3 См·м2/моль при бесконечном разбавлении. Вычислите константу кислотной диссоциации и степень диссоциации уксусной кислоты при этой концентрации. 92. Вычислите молярную электрическую проводимость раствора уксусной кислоты с концентрацией, равной 4,41·10-2 моль/л при 25°С, если известно, что его проводимость при бесконечном разбавлении равна 3,91·10-3 См·м2/моль, константа кислотной диссоциации равна 1,8·10-5. Коэффициенты активности примите равными 1. 93. Водный раствор Li Х (где Х – анион) с концентрацией 0,100 моль/л имеет удельную электрическую проводимость 0,895 См·м-1. Молярная электрическая проводимость иона Li+ равна 3,95·10-3 См·м2/моль. Вычислите молярную проводимость и молярную электрическую проводимость иона Х-. 94. Вычислите степень диссоциации уксусной кислоты в растворе с концентрацией равной 6,71·10-4 моль/л, а также рН раствора. Константа кислотной диссоциации СН3СООН равна 1,75·10-5. 95. Вычислите молярную электропроводимость раствора уксусной кислоты при бесконечном разведении при 298 К, если электропроводимости растворов HCl, CH3COONa, NaCl при бесконечном разведении соответственно равны: 0,0426; 0,0091; 0,0126 См·м2/моль. 96. При кондуктометрическом титровании 25 мл соляной кислоты раствором КОН (С = 0,1 моль/л) были получены следующие данные:
Определите концентрацию кислоты. 97. Удельная электропроводимость насыщенного водного раствора бромида таллия при 20°С равна 2,158·10-2 См/м, удельная электропроводимость воды равна 4,4·10-6 См/м. Молярная электропроводимость этой соли при бесконечном разведении составляет 1,383·10-2 См·м2/моль. Вычислите растворимость бромида таллия. 98. При температуре 298 К удельная электропроводимость насыщенного раствора йодида серебра равна 4,144·10-6 См/м, удельная электропроводимость воды, определенная в этих же условиях, 4,00·10-6 См/м. Вычислите концентрацию йодида серебра в насыщенном растворе. Предельные молярные электропроводимости ионов Ag+ и I- равны соответственно 53,5·10-4 и 66,5·10-4 См·м2/моль. 99. Удельная электропроводимость 0,7М раствора пропионовой кислоты при 291 К равна 9,25·10-2 См/м. Молярная электропроводимость при бесконечном разведении равна 346·10-4 См·м2/моль. Вычислите степень диссоциации пропионовой кислоты, концентрацию ионов водорода и константу диссоциации. 100. Удельная электропроводимость гидроксида натрия (ω = 10%) при температуре 291 К равна 31,24 См/м, плотность раствора 1,113 г/см3. Предельная молярная электропроводимость раствора равна 217,5·10-4 См·м2/моль. Вычислите степень диссоциации гидроксида натрия и концентрацию гидроксид-ионов. 101. При гидролизе лекарственного препарата выделяется соляная кислота, концентрация которой определяется кондуктометрическим титрованием. При титровании 50 мл препарата раствором гидроксида натрия (С = 0,5 моль/л), получены следующие данные:
Определите концентрацию свободной кислоты. 102. Молярная электропроводимость при бесконечном разведении раствора уксусной кислоты в 1,5 раза больше такой же электропроводимости раствора гидроксида аммония. Растворы 0,1М СН3СООН и 0,05М NH4ОН имеют одинаковую молярную электропроводимость. Каково соотношение степеней диссоциации этих электролитов в данных растворах? 103. Раствор слабой кислоты АН при 298 К и разведении 32 л имеет молярную электропроводимость 9,2·10-4 См·м2/моль, а при бесконечном разведении она равна 389·10-4 См·м2/моль. Рассчитайте концентрацию ионов водорода в этом растворе и константу диссоциации кислоты. 104. Удельная электропроводимость насыщенного раствора ВаСО3 в воде при 18ºС равна 25,475·10-4 См/м. Удельная электропроводимость воды равна 4,5·10-5 См/м. Молярные проводимости ионов Ва2+ и СО32- при 18ºС равны соответственно 55·10-4 и 66·10-4 См·м2/моль. Рассчитайте растворимость ВаСО3 в воде при 18ºС в моль/л. 105. Молярная электропроводимость бесконечно разбавленных растворов KCl, KNO3 и AgNО3 при 25ºС равна соответственно 149,9·10-4, 145,0·10-4 и 133,4·10-4 См·м2/моль. Какова молярная электропроводимость бесконечно разбавленного раствора AgCl при 25ºС? 106. Вычислите при 298 К ЭДС концентрированного элемента.
107. Определите ЭДС гальванического элемента, если стандартный потенциал хингидронного электрода равен 0,699 В.
108. ЭДС гальванической цепи равна 0,082 В. Определите рН желудочного сока.
109. При температуре 291 К ЭДС гальванической цепи, составленной из хингидронного и каломельного электродов равна 0,142 В. При 291 К потенциал каломельного электрода равен 0,25 В, а хингидронного равен (0,704 + 0,058 lg аН+). Определите рН раствора и концентрацию ионов водорода. Составьте гальваническую цепь. 110. Вычислите ЭДС гальванического элемента при 298 К Pb │ Pb 2+ ║ Ag+ │ Ag Концентрации растворов AgNO3 и Pb(NO3)2 равны 0,1 моль/л и 0,05 моль/л соответственно. Кажущаяся степень диссоциации Pb(NO3)2 равна 75%, а для раствора AgNO3 – 81%. 111. Вычислите ЭДС гальванического элемента (298 К), составленного из двух стеклянных электродов, погруженных в растворы соляной кислоты с рН = 1 и рН = 3. Мембраны стеклянных электродов идентичны. Составьте гальваническую цепь. 112. Вычислите рН биологического объекта, если при Т = 298 К, ЭДС гальванического элемента, составленного из хингидронного и каломельного электродов равна 210 мВ, потенциал каломельного электрода равен 0,337 В. Стандартный потенциал хингидронного электрода равен 0,699 В. Составьте гальваническую цепь. 113. Вычислите ЭДС гальванического элемента при 298 К Tl │ Tl + ║ Cu2+ │ Cu С = 0,1 моль/л С = 0,002 моль/л Кажущаяся степень диссоциации в растворе CuSO4 равна 40%, а в растворе Tl2SO4 – 87%. 114. Вычислите потенциалы электродов и ЭДС гальванического элемента при температуре 298 К. Zn │ Zn2+ ║ Cl+ │ Cl2, Pt Моляльность растворов ZnSO4 и HCl равна 0,1. Средние коэффициенты активности имеют значения: γm (ZnSO4) = 0,15 γm (HCl) = 0,8 115. Вычислите ЭДС гальванического элемента при 298 К: Ni │ Ni 2+ ║ Ag+ │ Ag Концентрации растворов NiSO4 и AgNO3 одинаковы и равны 5·10-3 моль/л. Степень диссоциации солей принять за единицу. 116. Вычислите ЭДС цепи: Со │ Co(NO3)2 ║ AgNO3 │ Ag при 25ºС, если кажущиеся степени диссоциации AgNO3 и Co(NO3)2 в растворах соответственно равны 82% и 87%, концентрации растворов AgNO3 и Co(NO3)2 равны 0,1 и 0,01 моль/л. 117. Составьте схему гальванического элемента, в котором протекает реакция: Ag+ + Br- = AgBr Рассчитайте стандартную ЭДС элемента при 25ºС, изменение энергии Гиббса и константу равновесия. 118. Изменение энтальпии реакции Pb + Hg2Cl2 = PbCl2 + 2Hg, протекающей в гальваническом элементе равно (– 94,2 кДж/моль) при 298 К. ЭДС этого элемента возрастает на 1,45·10-4 В при повышении температуры на один градус. Рассчитайте ЭДС элемента и изменение энтропии при 298 К. 119. В гальваническом элементе обратимо протекает реакция CuSO4 + Zn = ZnSO4 + Cu Рассчитайте ΔН и ΔS реакции, если ЭДС элемента равна 1,0960 В при 273 К и 1,0961 В при 276 К. 120. Рассчитайте потенциал водородного электрода в чистой воде при 25ºС. 121. Срок годности лекарственного вещества при 20ºС составляет 2 года. Как изменится срок годности лекарства, если хранить его в холодильнике (tº = 4ºС)? (Температурный коэффициент равен 2). 122. Некоторая химическая реакция относится к типу А + В → С + D. При одинаковых начальных концентрациях А и В для времени полупревращения получены следующие данные:
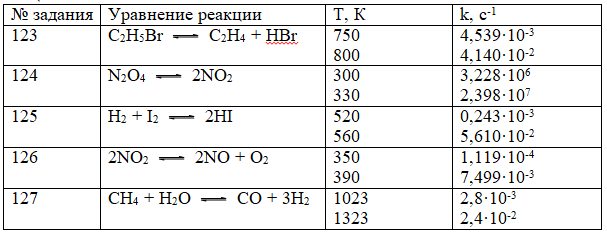
Докажите, что реакция следует кинетике второго порядка. 123-127. Вычислите энергию активации химической реакции по данным таблицы:
128. Константа скорости реакции COCl2 → CO + Cl2 равна 5,3·10-3 мин-1. Определите, какое количество вещества прореагирует за 10 минут, если исходная концентрация его равна 0,8 моль/л? 129. Разложение перекиси водорода в водном растворе является реакцией первого порядка. Период полупревращения равен 15,86 минут. Определите, какое время потребуется для разложения 99% перекиси водорода при заданных условиях. 130. Определите энергию активации для некоторой реакции, если скорость реакции увеличилась в три раза при возрастании температуры на 10º: Т1 = 300 К; Т2 = 310 К 131. Докажите графически, что реакция термического разложения ацетальдегида в газовой фазе протекает по уравнению второго порядка по следующим кинетическим данным:
132. Дана зависимость константы скорости разложения N2O5 от температуры:
Определите графически энергию активации и константу скорости при 323 К. 133. Для реакции разложения N2O5 в тетрахлориде углерода график зависимости lg C(N2O5) от времени представляет прямую линию. Константа скорости этой реакции при 45ºС равна 6,2·10-4 с-1. Какое время потребуется для 20%-ного разложения? 134. Химическую реакцию изучают при двух температурах 27ºС и 37ºС. Константы скорости при этих температурах соответственно равны 3,4 мин-1 и 8,5 мин-1. Рассчитайте: а) энергию активации для этой реакции, б) температурный коэффициент (γ) реакции. 135. Энергия активации некоторой реакции равна 65 кДж/моль. Константа скорости при 20ºС равна 1,2 мин-1. Рассчитайте константу скорости реакции при 0ºС. 136. Венгерский препарат «Калий - нормин» нормализует количество ионов калия в сыворотке крови. После приёма таблеток концентрация ионов калия изменилась следующим образом:
Определите порядок реакции и константу скорости реакции. 137. Реакция HCHO + H2O2 HCOOH + H2O второго порядка. Если смешать равные объемы одномолярных растворов,то через два часа при температуре 500С концентрация муравьиной кислоты будет равна 0,165 моль/л. Определите константу скорости реакции и время, которое потребуется, чтобы прореагировало 85% исходных веществ. 138. При ядерных взрывах появляются изотопы азота. Один из изотопов азота имеет период полураспада 9,86 часа. Определите, какая часть его распадается через 16 часов после начала процесса? 139. Сахароза в присутствии Н+ подвергается гидролизу: С12Н22О11 + Н2О С6Н12О6 + С6Н12О6. глюкоза фруктоза Средняя константа скорости равна 2,07·10-4 с -1. Определите, какой процент сахарозы прореагирует через час после начала реакции? 140. Константа скорости реакции второго порядка НСНО + Н2О2 НСООН + Н2О при 600С равна 2,095·10-4 л/моль·с Определите массу муравьиной кислоты, которая образуется через один час, если смешать но 0,5 литра одномолярных растворов формальдегида и перекиси водорода. 141. Фармацевтический препарат этилхлорид вызывает временную анестезию. При гидролизе в среде 80% этилового спирта изменение его концентрации происходит следующим образом:
Определите порядок реакции, период полупревращения и константу скорости реакции. 142. Константа скорости гидролиза новокаина при 323 К равна 7,2·10-7мин-1, энергия активации реакции равна 55215 Дж/моль. Определите, сколько процентов новокаина прореагирует за 15 дней хранения препарата при 150С? 143. Константа скорости реакции разложения сульфацила натрия при 1500 равна 4,2·10-4с-1. Определите константу скорости реакции и температурный коэффициент (γ) при 1800 С. 144. Температурный коэффициент скорости реакции гидролиза 5%-го норсульфазола натрия равен 2,5. Определите температуру, при которой нужно проводить «искусственное старение» препарата, чтобы скорость реакции возросла в 70 раз. 145. При изучении кинетики реакции гидролиза сахарозы получили следующие данные:
Вычислите температурный коэффициент для каждого температурного интервала. 146. При хранении таблеток амидопирина было установлено, что при температурах 800С и 900С константы скорости разложения лекарственного препарата соответственно равны 1,62·10-6с-1 и 4,15·10-6 с-1 Определите срок хранения таблеток при 250C (считая годным, если разложится 10% вещества). 147.За 10 дней содержание раствора лекарственного препарата в растворе при гидролизе уменьшилось на 5,45%. Определите константу скорости реакции и период полупревращения. 148. При изучении кинетики реакции гидролиза аллилхлорида в 80%-ом этиловом спирте получены следующие данные:
Определите графически энергию активации реакции и константу скорости реакции при 300С. 149.Для определения срока годности порошка папаверина гидрохлорида проведено «ускоренное старение» при температурах 600С и 800С, константы скорости разложения соответственно равны 2,17·10-5час-1 и 4,17·10-5 час-1. Определите срок годности порошка при температуре 250С (считая годным, если разложится 10% вещества). 150.Денатурация белка (реакция первого порядка) при 500С прошла за 13,75 минуты на 50%. Определите время его распада на 85% при этих же условиях.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||