| Общая информация » Каталог студенческих работ » ЕСТЕСТВЕННЫЕ ДИСЦИПЛИНЫ » Физическая и коллоидная химия |
| 03.11.2017, 11:57 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
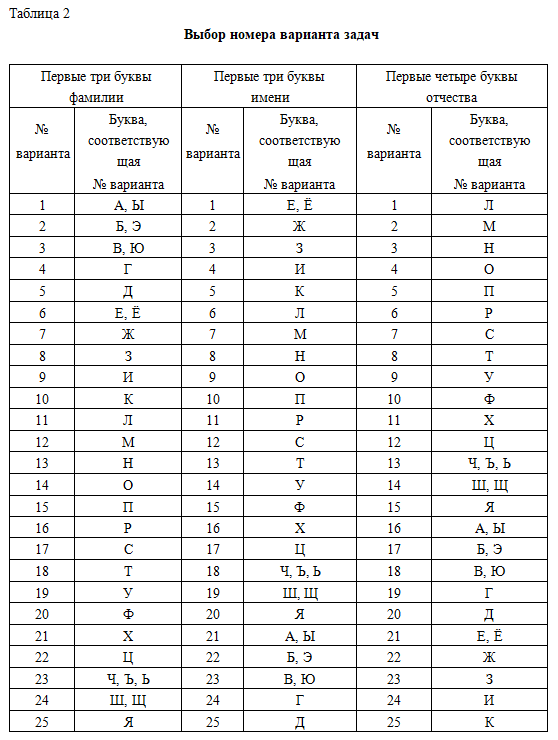
Выбор варианта задач для решения 1. Написать на первой странице тетради полностью свою фамилию, имя и отчество, например, Попова Ирина Васильевна. 2. Выписать в ряд по три первые буквы фамилии, имени и четыре отчества и пронумеровать их. Цифра соответствует номеру задачи. Всего десять задач. 3. Для выбора варианта задачи надо букву, стоящую над номером задачи, найти в табл. 2. Номер строки, в которой находится данная буква, соответствует номеру варианта. Номера варианта выписываются под номерами задач. Для нашего варианта получим следующую таблицу: Таблица 1
4. Перед решением каждой задачи нужно записать ее номер, номер варианта, полностью условие задачи и привести подробный ход решения задачи с объяснением.
Тема 1. Первое начало термодинамики Задание 1 1.1. Определить количество теплоты, выделяющейся при охлаждении 0,2 кг кислорода от 80 до 100С, если объем остался неизменным. 1.2. При 900С давление 2∙10-2 кг азота составляло 5∙104 н/м2. После изотермического сжатия давление увеличилось до 1∙105 н/м2. Рассчитать работу сжатия. 1.3. Какое количество теплоты выделится при охлаждении 1 моля водорода от 70 до 200С, при постоянном давлении? 1.4. Сколько теплоты потребуется, чтобы нагреть 5 кг газообразного аммиака на 100С при постоянном объеме? 1.5. Сколько нужно затратить теплоты на нагревание 22,4 л аргона от 10 до 1200С при постоянном давлении? 1.6. Найти работу изотермического расширения 2 молей SO2 при 350 К. Объем увеличился от 1 до 5 м3. 1.7. 3 л неона, взятого при нормальных условиях, охлаждают до -700С. Определить количество теплоты, отобранное у неона, если объем остался неизменным. 1.8. 0,2 кг брома конденсируется при 590С и давлении 1∙105 Па. Удельная теплота испарения брома λ = 1,9∙105 Дж/кг. Рассчитать изменение внутренней энергии. Объемом жидкого брома пренебречь. 1.9. 5 л неона, взятого при нормальных условиях, нагревают до 4000С при постоянном объеме. Определить количество теплоты, затраченное на нагревание. 1.10. 2 кг криптона охлаждают при постоянном давлении. Найти изменение энтальпии, если температура уменьшилась на 1500С. 1.11. 52 кг азота нагревают при постоянном давлении. Найти изменение энтальпии, если температура повысилась на 800С. 1.12. Найти изменение внутренней энергии при испарении 1 кг этанола при температуре 780С. Теплота испарения λ = 39 кДж/моль. Удельный объем пара 28 л/моль. Объемом жидкого этанола пренебречь. 1.13. Чему равно изменение внутренней энергии при испарении 0,3 кг воды при 250С. Удельная теплота парообразования воды λ = 44 кДж/моль. Объемом жидкой воды пренебречь. 1.14. При 100С и начальном давлении 5∙106 н/м2 0,02 м3 кислорода расширяются изотермически до давления 9∙106 н/м2. Вычислить работу расширения. 1.15. Найти изменение внутренней энергии 1 моль неона, изобарно расширяющегося от 5 до 10 м3 под давлением 2∙102 Па. 1.16. При 1100С 6 кг азота занимают объем 3 м3. Вычислить работу при изотермическом расширении до объема 4 м3 . 1.17. Вычислить работу расширения, если 2 кг кислорода при 400С расширяется от 0,02 до 0,2 м3. 1.18. При постоянном давлении 1∙105 н/м2 воздух расширился от объема 0,02 м3 до объема 0,3 м3. Определить работу расширения. 1.19. При постоянном давлении 1∙104 Па, нагревают 0,5 м3 водорода. Определить совершенную работу, если газ расширился до 0,9 м3. 1.20. Вычислить работу расширения газовой системы на 0,3 м3 и постоянном давлении равном 1∙104 н/м2. 1.21. Определить количество теплоты, необходимое для нагревания 0,2 кг азота от 25 до 600С при постоянном объеме. 1.22. Определить количество теплоты, которое нужно затратить при постоянном объеме 5 м3, чтобы увеличить давление азота от 5∙105 н/м2 до 1∙106 н/м2. 1.23. 0,05 м3 азота, взятого при нормальных условиях, нагревают до 2000С при постоянном объеме. Определить количество теплоты, затраченное на нагревание. 1.24. Определить количество теплоты, необходимое для нагревания при постоянном объеме 2 кг аммиака, находящегося при 2000С, от 1∙104 до 5∙104 н/м2. 1.25. Определить количество теплоты, необходимое для нагревания 3 кг азота от 20 до 500С при постоянном объеме.
Тема 2. Второе начало термодинамики Задание 2 2.1. Найти изменение энтропии при охлаждении 0,3 моль метанола от 90 до -100С. Температура кипения – 650С, теплота испарения – 148 кДж/моль; теплоемкость – Српар =176 Дж/моль∙К; теплоемкость – Сржид = 43 Дж/моль∙К. 2.2. Найти изменение энтропии при нагревании 2 моль тетрахлорида углерода (ССl4) от -10 до 1200С. Температура кипения 770С, теплота испарения – 132 кДж/моль, теплоемкость – Срж = 554 Дж/моль∙К, теплоемкость – Срг = 39 Дж/моль∙К. 2.3. Найти изменение энтропии при нагревании 30 г этанола от -130 до +900С. Удельная теплоемкость – Сртв = 7 Дж/г∙К; Срж = 9,6 Дж/г∙К; Срг = 7,6 Дж/г∙К; удельная теплота плавления при -1120С 790 Дж/г, удельная теплота парообразования при 780С 3840 Дж/г. 2.4. Как изменится энтропия при охлаждении 3 моль этанола от 1200С до 280К. Температура кипения – 780С; молярная теплоемкость – Срж = 111 Дж/моль∙К; теплоемкость – Срг = 19 Дж/моль∙К; теплота испарения – 40 кДж/моль. 2.5. Найти изменение энтропии 2 молей паров бензола от 80 до 600С. Температура кипения бензола 353К; молярная теплота парообразования – 40 кДж/моль; теплоемкость жидкого бензола – 140 Дж/моль∙К. 2.6. Как изменится энтропия при охлаждении 3 моль хлорида натрия от 1073К до 3000С. Температура плавления 8000С, теплота плавления – 30 кДж/моль, молярная теплоемкость – Сртв = 46 Дж/моль∙К. 2.7. Найти изменение энтропии при нагревании 2 моль жидкого метана от 112К до 200С. Температура кипения – 112К, теплота парообразования – 8234 Дж/моль∙К. 2.8. Рассчитать изменение энтропии при охлаждении 3 моль ацетона (С3Н6О) от 100 до 200С. Температура кипения – 560С, теплота испарения – 30 кДж/моль, молярная теплоемкость пара – 22 Дж/моль∙К, жидкости – 125 Дж/моль∙К. 2.9. Как изменится энтропия при нагревании 2 молей серы от 20 до 2100С, если теплота плавления – 1440 Дж/моль, температура плавления – 1190С, молярная теплоемкость жидкой серы – 36 Дж/моль∙К, твердой – 24 Дж/моль∙К. 2.10. Найти изменение энтропии при охлаждении 200 г толуола (С7Н8) от 80 до -400С. Температура плавления -350С, удельная теплота плавления 132Дж/г, удельная теплоемкость жидкого толуола – 1,7 Дж/г∙К, твердого – 1,1 Дж/г∙К. 2.11. Найти изменение энтропии 2 молей метанола от -1100С до +40оС. Температура плавления -98оС, теплоемкость – Сртв = 256 Дж/моль∙К, Срж = 432 Дж/моль∙К, теплота плавления – 22 кДж/моль. 2.12. Найти изменение энтропии при охлаждении 40 г пара метановой кислоты (СН2О2) от 120 до -100С. Удельная теплота плавления – 772 Дж/г, парообразования – 1365 Дж/г, удельная теплоемкость – Срг = 5,6 Дж/г∙К, Сртв = 7,6 Дж/г∙К, температура плавления – 8,50С, кипения – 1200С. 2.13. Вычислить возрастание энтропии 159,8 г твердого Br2, взятого при температуре плавления -7,30С, и при переходе его из твердого состояния в пар при температуре кипения 61,50С, удельная теплоемкость жидкого брома – Срж = 0,45 Дж/гК, теплота плавления – 67,72 Дж/г, теплота испарения – 182,8 Дж/г. 2.14. Рассчитать изменение энтропии при превращении 0,1 кг воды, взятой при 00С, в пар при 1200С. Теплота испарения воды при 1000С – 40,6 кДж/моль, теплоемкость жидкой воды – 75,3 Дж/мольК, теплоемкость пара – 360 Дж/мольК. 2.15. Рассчитать изменение энтропии 20 г этанола С2Н5ОН при переходе из жидкого состояния при 250С и 1,013∙105 Па в пар при температуре 780С и 0,050∙105 Па. Молярная теплота испарения этанола – 40,79 кДж/моль, теплоемкость – Срж = 104 Дж/мольК. 2.16. Найти изменение энтропии при нагревании 5 моль твердого метилового спирта от -98 до +500С, если теплоемкость равна 256 Дж/моль, теплота плавления – 22,4 кДж/мольК, температура плавления -980С. 2.17. Найти изменение энтропии при конденсации 100 г этилового спирта при 780С и охлаждении до 200С, если удельная теплота парообразования этилового спирта равна 3840 Дж/г, удельная теплоемкость жидкого – спирта 7,6 Дж/г. 2.18. Найти изменение энтропии при нагревании 0,076 кг бензола С6Н6 от 0 до 500С, если удельная теплоемкость твердого бензола равна 1,5 кДж/кгК, жидкого бензола – 1,8 кДж/кгК, теплота плавления – 126 кДж/кг, температура плавления 50С. 2.19. Найти изменение энтропии при охлаждении 0,050 кг ртути от 20 до -500С, если удельная теплоемкость жидкой ртути – 0,6 кДж/кгК, твердой ртути – 0,6 кДж/кгК, удельная теплота плавления – 50 кДж/кг, температура плавления -39оС. 2.20. Найти изменение энтропии при нагревании 0,2 кг ртути от 20 до 3800С, если удельная теплоемкость жидкой ртути равна 0,6 кДж/кгК, паров ртути – 0,7 кДж/кгК, удельная теплота испарения – 1210 кДж/кг, температура кипения 3570С. 2.21. Найти изменение энтропии при охлаждении 1 моль ацетона С3Н6О от 100 до 250С, если теплота испарения ацетона равна 29,8 кДж/моль, температура кипения – 56оС, Срж = 125 Дж/мольК, Срг = 22,5 Дж/мольК. 2.22.Рассчитать изменение энтропии при нагревании 1моль кадмия от 25 до 7240С, если температура плавления 3210С и теплота плавления равна 6109 Дж/моль. СртвCd = 22,2 Дж/мольК, СржСd = 29,8 Дж/мольК. 2.23. Как изменится энтропия при нагревании 1 моль хлорида натрия от 250С до 1073К, если температура его плавления – 8000С, теплота плавления – 30,23 кДж/моль, молярная теплоемкость – Ср = 45,96 Дж/мольК. 2.24. Вычислить изменение энтропии при смешении 0,001 м3 водорода с 0,00005 м3 метана, если исходные газы и образующаяся смесь газов находится при 250С и давлении 0,912∙105 Па. 2.25. Насколько изменится энтропия в процессе изотермического расширения 0,010 кг криптона от объема 0,05 м3 и давления 1,013∙105 Па до объема 0,2 м3 и давления 0,2133∙105 Па?
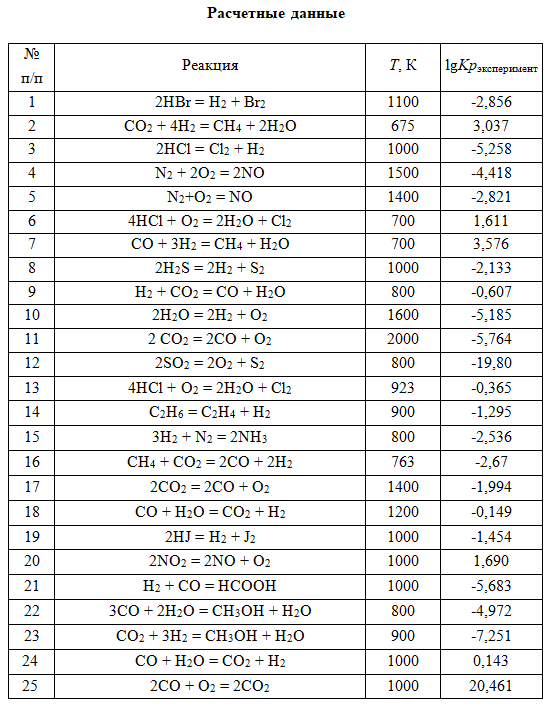
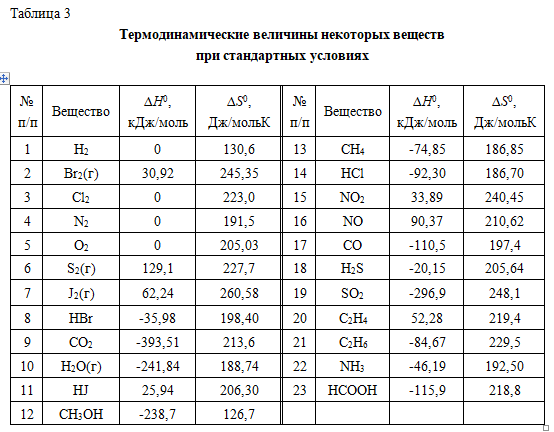
Тема 3. Термодинамические потенциалы. Химическое равновесие. Фазовое равновесие. Задание 3 Найти ∆G0, Кр и КС приведенной реакции при указанной температуре К. Кр сравните с экспериментальным значением.
Тема 4. Кинетика химических реакций Задание 4 4.1. Как изменятся скорости прямой и обратной реакций 4НСl + O2 = 2H2O(г) + 2Cl2 при увеличении давления в два раза и неизменной температуре? 4.2. Во сколько раз увеличится скорость прямой реакции 2SO2 + O2 = 2SO3 , протекающей в закрытом сосуде, если увеличить давление в 5 раз без изменения температуры? 4.3. Как изменятся скорости прямой и обратной реакций N2 + O2 = 4NO + 6H2O , протекающих в закрытом сосуде при высокой температуре, если увеличить давление в 3 раза? 4.4. Реакция идет по уравнению 4NH3 + 5O2 = 4NO + 6H2O. Как изменится скорость прямой реакции, если увеличить давление в 2 раза? 4.5. Реакция идет согласно уравнению 4NH3 + 5O2 = 4NO + 6H2O. Как изменится скорость обратной реакции, если уменьшить давление в 3 раза? 4.6. Реакция выражается уравнением 4НСl + O2 = 2H2O + 2Cl2 . Как изменится скорость прямой реакции, если увеличить давление в 4 раза? 4.7. Как изменится скорость обратной реакции 4НСl + O2 = 2H2O + 2Cl2 , при увеличении давления в 2 раза? 4.8. Как изменится скорость прямой реакции, протекающей по уравнению 2NO + O2 = 2NO2, если увеличить объем в 3 раза? 4.9. Найти изменение скорости прямой реакции 2SO2 + O2 = 2SO3 при уменьшении объема в 3 раза? 4.10. Как изменится скорость прямой и обратной реакции H2 + Cl2 = 2HCl при увеличении объема в 3 раза? 4.11. Изменится ли скорость прямой реакции FeO3(тв) + CO = Fe(тв) + CO2 при уменьшении объема в 3 раза? 4.12. Как изменится скорость прямой реакции 2SO3(г) = 2SO2 + O2 при сжатии системы в 3 раза? 4.13. Реакция выражается уравнением 2Cl2 + 2H2O = 4HCl + O2 . Как изменится скорость прямой реакции при уменьшении объема в 3 раза? 4.14. Реакция выражается уравнением 2Cl2 + 2H2O = 4HCl + O2 . Как изменится скорость обратной реакции при увеличении объема в 3 раза? 4.15. Как изменится скорость реакции 2NO + O2 = 2NO2, если увеличить температуру с 200С до 600С? Температурный коэффициент реакции равен 2. 4.16. Найти изменение скорости реакции синтеза аммиака 2N2 + 3H2 = 2NH3 при увеличении температуры от 2000С до 2500С. Температурный коэффициент реакции считать равным 3. 4.17. Найти изменение скорости реакции H2+Cl2 = 2HCl при уменьшении температуры от 100 до 800С. Температурный коэффициент реакции равен 2. 4.18. Найти изменение скорости реакции H2O + C = CO + H2 при уменьшении температуры от 100 до 800С. Температурный коэффициент реакции равен 2. 4.19. Во сколько раз изменится скорость реакции, если изменение температуры составило 300С, а температурный коэффициент реакции равен 3? 4.20. Найти изменение скорости реакции при уменьшении температуры на 200С, если температурный коэффициент реакции равен 2. 4.21. При повышении температуры на 200С скорость реакции возросла в 9 раз. Чему равен температурный коэффициент этой реакции? 4.22. При повышении температуры на 400С скорость реакции возросла в 32 раза. Чему равен температурный коэффициент этой реакции? 4.23. При уменьшении температуры на 300С скорость реакции уменьшилась в 27 раз. Чему равен температурный коэффициент этой реакции? 4.24. При уменьшении температуры на 200С скорость реакции уменьшилась в 16 раз. Чему равен температурный коэффициент этой реакции? 4.25. Чему равен температурный коэффициент реакции, если при увеличении температуры на 300С скорость реакции увеличилась в 27 раз?
Тема 5. Растворы неэлектролитов Задание 5 5.1. Вычислить давление пара 20% раствора гюкозы (С6Н12О6) при 250С. Давление паров воды при данной температуре равно 3167,7 Н/м2. 5.2. Вычислить давление пара раствора 6,4 г нафталина (С10Н8) в 90 г бензола при 200С. Давление паров бензола равно 9953,8 Н/м2. 5.3. В 150 г водного раствора содержится 34,2 г сахара (С12Н22О11). Вычислить давление пара этого раствора при 300С, если давление паров воды – 4242 Н/м2. 5.4. Вычислить давление пара 1%-ного раствора хлористого натрия (NaCl) при 1000С. Степень диссоциации соли в растворе принять равной единице. 5.5. Сколько граммов глицерина (С3Н8О3) надо растворить в 90 г воды при 300С, чтобы понизить давление пара на 266,5 Н/м2? 5.6. В 200 г раствора нафталина (С10Н8) в бензоле (С6Н6) содержится 60 г нафталина. Вычислить давление пара данного раствора при 400С. Давление пара бензола равно 24144,6 Н/м2. 5.7. Вычислить давление пара 5%-ного раствора анилина (С6Н5NH2) в эфире (С2Н5)2О при 200С. Давление пара чистого эфира равно 58920 Н/м2. 5.8. Определить концентрацию сахара (С12(Н2О)11) в растворе, если раствор закипает при 100,50С. Эбуллиоскопическая постоянная воды = 0,52. 5.9. При какой температуре будет кипеть 50%-ный раствор сахара (С12(Н2О)11) в воде (ЕЭ = 0,52) ? 5.10. При растворении 6,48 г серы в 80 г бензола (С6Н6) температура кипения последнего повысилась на 0,810. Из скольких атомов состоит молекула серы в растворе (ЕЭ = 2,57)? 5.11. Сколько граммов глюкозы (С6(Н2О)6) нужно добавить к 100 г воды, чтобы раствор закипел при 102,50С (ЕЭ = 0,52)? 5.12. Имеются 25%-ные водные растворы мочевины, глицерина и фруктозы. В какой последовательности будут закипать эти растворы при постепенном нагревании их. Дать обоснованный ответ, не производя вычислений (мочевина – СN2Н4О, глицерин – С3Н8О3, фруктоза – С6Н12О6). 5.13. Какова концентрация водного раствора глюкозы (С6Н12О6), если он замерзает при -10С (ЕК = 1,86) ? 5.14. Сколько глицерина (С3Н5(ОН)3) нужно добавить к 1000 г воды, чтобы раствор не замерзал до -50С (ЕК = 1,86) ? 5.15. Какой из растворов будет замерзать при более низкой температуре: 5%-ный раствор глицерина (С3Н8О3) или 5%-ный раствор глюкозы (С6Н12О6)? Дать мотивированный ответ, не производя вычислений. 5.16. В каком весовом отношении надо смешать воду и глицерин (С3Н5(ОН)3), чтобы получить смесь, замерзающую при -200С (Ек=1,86)? 5.17. Температура замерзания чистого бензола (С6Н6) – 5,50С, а раствора, содержащего 0,2242 г камфоры, – 30,55 г; бензола – 5,2540С. Определить молекулярную массу камфоры в бензоле (Ек = 5,1). 5.18. Сколько сахара (С12(Н2О)12) надо растворить в 100 г воды, чтобы понизить температуру замерзания на 10С (Ек = 1,86)? 5.19. При растворении 15 г хлороформа (СНСl3) в 400г диэтилового эфира ((С2Н5)2О) температура кипения последнего повысилась на 0,6350С. Вычислить значение молекулярной массы хлороформа (ЕЭ = 2,02). 5.20. Из скольких атомов состоит молекула йода в спирте (С2Н5ОН), если температура кипения этилового спирта 78,30С повышается до 78,590С при растворении йода массой 12,7 г в спирте массой 200 г? 5.21. Сколько молей неэлектролита должен содержать литр раствора, чтобы осмотическое давление при 00С равнялось 5 бар? 5.22. Определить молекулярную массу растворенного вещества, если раствор, содержащий 12 г растворенного вещества в литре, при 170С обладает осмотическим давлением, равным 4,82 бар? 5.23. Сколько граммов этилового спирта (С2Н5ОН) нужно растворить в 200 см3 воды, чтобы осмотическое давление этого раствора при 170С было равно 2 бар? 5.24. Осмотическое давление раствора, содержащего в 500 см3 1,55 г анилина (С6Н5NH2) при 210С равно 0,81 бар.Определить молекулярную массу анилина. 5.25. Не вычисляя величин осмотического давления, ответить: какой раствор обладает большим осмотическим давлением – содержащий в литре 3 г нафталина С10Н8 или 3 г антрацена С14Н10?
Тема 6. Растворы электролитов Задание 6 6.1. При 180С удельная электропроводность 0,7Н раствора Mg(NO3)2 равна 4,38∙10-2 Ом-1см-1. Найти эквивалентную электропроводность и кажущуюся степень диссоциации этого раствора, если эквивалентная электропроводность при бесконечном разбавлении равна 109,8 Ом-1см-1. 6.2. Удельная электропроводность 10%-ного раствора СаCl2 при 180С 11,4∙10-2 Ом-1см-1, плотность – 1,08 г/см3. Вычислить значение эквивалентной электропроводности и кажущуюся степень диссоциации СаСl2 в растворе. Эквивалентная электропроводность этого раствора при бесконечном разбавлении = 116 Ом-1см2. 6.3. Удельная электропроводность 20%-ного раствора NH4Cl при 180С 0,337 Ом-1см-1, плотность – 1,057 г/см3. Вычислить значение эквивалентной электропроводности и кажущуюся степень диссоциации. Эквивалентная электропроводность при бесконечном разбавлении = 130 Ом-1см2. 6.4. Удельная электропроводность 0,1Н раствора уксусной кислоты равна 4,6∙10-2 Ом-1м-1. Вычислить значение эквивалентной электропроводности этого раствора. 6.5. Удельная электропроводность 0,02Н раствора ацетата натрия равна 16,2∙10-2Ом-1см-1. Найти эквивалентную электропроводность этого раствора. 6.6. При 180С удельная электропроводность 0,08% раствора аммиака 6,86∙10-4 Ом-1см-1, плотность – 0,996 г/см3. Константа диссоциации NH4OH 1,79∙10-5. Вычислить значение эквивалентной электропроводности при бесконечном разбавлении. 6.7. При 220С удельная электропроводность 9,55% раствора муравьиной кислоты 7,56∙10-3 Ом-1см-1, плотность – 1,024 г/см3. Константа диссоциации муравьиной кислоты 1,77∙10-4. Вычислить значение эквивалентной электропроводности при бесконечном разбавлении. 6.8. При 250С константа электролитической диссоциации монохлоруксусной кислоты равна 1,4∙10-3, а ее эквивалентная электропроводность при разведении в 32 л/экв – 77,2 Ом-1см-1. Вычислить значение эквивалентной электропроводности при бесконечном разбавлении. 6.9. Константа электролитической диссоциации азотистой кислоты при 12,50С равна 4,6∙10-4. Вычислить степень электролитической диссоциации 0,05Н раствора. 6.10. Удельная электропроводность раствора метиламина при 250С и концентрации 0,07Н равна 1,31∙10-3 Ом-1см-1. Вычислить константу диссоциации метиламина. Эквивалентная электропроводность при бесконечном разбавлении 250 Ом-1см2. 6.11. Удельная электропроводность 0,02Н раствора ацетата натрия равна 16,2∙10-2 Ом-1см-1. Подвижности катиона и аниона соответственно равны 4,26∙10-3 и 4,7∙10-3 Ом-1м2. Найти кажущуюся степень диссоциации. 6.12. При 180С эквивалентная электропроводность раствора пропиламина при разведении в 64 л/экв равна 35,4 Ом-1см-1. Константа диссоциации пропиламина 4,7∙10-4. Вычислить значение степени диссоциации. 6.13. Константа электролитической диссоциации ортоборной кислоты (H3BO3) по первой ступени при 250С равна 5,8∙10-10. Вычислить степень электролитической диссоциации при разведении в 24 л/экв. 6.14. Вычислить, при какой концентрации раствора NH4OH степень электролитической диссоциации равна 0,02. Какова при этом концентрация ионов гидроксила? Константа электролитической диссоциации NH4OH равна 1,79∙10-5. 6.15. При каком разведении концентрация ионов водорода в растворе фенола будет равна 10-6Н? Константа электролитической диссоциации фенола 1,28∙10-10. 6.16. Удельная электропроводность раствора NH4OH при 180С и концентрации 0,011Н имеет величину 1,02∙10-4Ом-1см-1. Вычислить степень диссоциации NH4OH, если подвижность NH 4 =63,6 Ом см , а ОН =174Ом см . 6.17. Удельная электропроводность раствора NH4OH при 180С и концентрацией 0,022Н составляет 1,5∙10-4 Ом-1см-1. Вычислить концентрацию ионов ОН-, если подвижность NH4+ =63,6 Ом-1см2, а ОН= 174 Ом-1см2. 6.18. Удельная электропроводность раствора бензиламина при 250С и разведении 16 л/экв равна 2,56∙10-4. Вычислить степень диссоциации бензиламина, если λ∞=215,8 Ом-1см-1. 6.19. Удельная электропроводность раствора бензиламина при 250С и разведении 64 л/экв равна 1,3∙10-4. Вычислить константу диссоциации, если λ∞=215,8 Ом-1см-1. 6.20. Удельная электропроводность 0,405Н раствора HJ при 180С 13,32∙10-2 Ом-1см-1. Каково значение кажущейся концентрации ионов водорода в растворе, если подвижность ионов водорода – 315 Ом-1см2, ионов J– 66,8 Ом-1см2? 6.21. Эквивалентная электропроводность раствора уксусной кислоты при 250С и разведении 32 л/экв равна 8,2 Ом-1см-1. Вычислить константу электролитической диссоциации. Подвижность ионов водорода – 315 Ом-1см2, ионов CH3COO– 35 Ом-1см2. 6.22. При каком разведении концентрация ионов водорода в растворе муравьиной кислоты будет равна 1∙10-3Н. Константа электролитической диссоциации 1,77∙10-4. 6.23. Вычислить константу электролитической диссоциации 0,4% раствора аммиака, если при 180С удельная электропроводность раствора 4,9∙10-4 Ом-1см-1. Плотность раствора принять равной единице. 6.24. Вычислить константу электролитической диссоциации 1%-ного раствора пропионовой кислоты, если при 180С удельная электропроводность раствора 4,79∙10-4 Ом-1см-1. Плотность раствора принять равной единице. Для пропионовой кислоты λ∞=344 Ом-1см-1. 6.25. Эквивалентная электропроводность 0,1М раствора СаСl2 82,8 Ом-1см2, при бесконечном разбавлении λ∞ = 115,8 Ом-1см2. Найти величину кажущейся степени диссоциации и значение удельной электропроводности. Таблица 5 Подвижность ионов при 180С
Примечание. Для перевода в СИ значения lK и lA следует умножить на 1∙10-4.
Тема 7. Электродные потенциалы и гальванические цепи Задание 7 Вычислить электродвижущую силу окислительно-восстановительного элемента, составленного из двух полуэлементов А и В. Напишите протекающую в нем реакцию. Стандартные потенциалы взять из табл. 6. Расчетные данные
Таблица 6 Стандартные электродные потенциалы при 250С
КОЛЛОИДНАЯ ХИМИЯ Тема 8. Коллоидные системы Задание 8 Коллоидный раствор получен в результате реакции обмена при смешении равных объемов растворов А и В разных концентраций. Напишите и объясните формулу мицеллы золя и схему ее строения. Определите, какой из двух электролитов будет иметь меньший порог коагуляции. Расчетные данные
Тема 9. Микрогетерогенные системы. Высокомолекулярные соединения Задание 9 Определить, сколько растворителя поглотит указанное количество высокомолекулярного соединения при заданной степени набухания.
Вычислить степень набухания, если известна масса сухого полимера m0 и набухшего m. Расчетные данные
Задание 10 10.1. Что называется адсорбцией? Чем она обусловлена и какими уравнениями описывается? 10.2. В чем состоят особенности строения молекул ПАВ и ПИВ и их адсорбция? 10.3. Чем отличается физическая адсорбция от хемосорбции? 10.4. Перечислите особенности ионной адсорбции. Как она зависит от размеров и зарядов ионов? 10.5. Какие методы получения дисперсных систем вы знаете? 10.6. Какие оптические методы используют для определения размеров частиц дисперсной фазы? 10.7. Какие явления называются электрокинетическими? Перечислите их, пояснив сущность протекающих процессов. 10.8. В чем состоят различия между молекулярно-кинетическими свойствами коллоидных и истинных растворов? 10.9. Сформулируйте правила коагуляции золей электролитами. 10.10. В чем заключается защитное действие ВМС и сенсибилизация коллоидов? 10.11. Какие свойства называются тиксотропией и синерезисом? 10.12. Что общего и в чем состоит различие между низкомолекулярными и коллоидными ПАВ? 10.13. Как можно классифицировать ВМС по происхождению, по строению молекул? 10.14. Каково строение молекулы белка? 10.15. Что такое «студень» и «явление синерезиса»? 10.16. Чем определяется возможность образования структуры в суспензии? Какие факторы влияют на структурообразование? 10.17. Применение суспензий в пищевой промышленности. 10.18. Какие системы называются эмульсиями? Как они классифицируются и где применяются? 10.19. Какие вы знаете факторы устойчивости пены? Как можно предотвратить образование пены в технологическом процессе? 10.20. Какими методами можно разрушать аэрозоли? 10.21. Что такое «порошок»? Как получают и как классифицируют? 10.22. Какие системы называют нормально вязкими? Как вязкость зависит от приложенного давления? 10.23. Что называется изоэлектрической точкой и каково ее значение для большинства белковых веществ? 10.24. Чем отличается эластичный студень от хрупкого геля? Что такое «тиксотропия»? 10.25. Зависит ли вязкость от приложенного давления? Начертите кривые зависимости вязкости от давления для структурированной системы. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||