| Общая информация » Каталог студенческих работ » ЕСТЕСТВЕННЫЕ ДИСЦИПЛИНЫ » Химия |
| 27.11.2025, 14:34 | |
ЗАДАНИЯ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ Раздел 1. Основные законы и понятия химии 1. В какой массе NaOH содержится столько же эквивалентов, сколько в 140 г КОН? 2. Определите эквивалент и эквивалентную массу фосфора, кислорода и брома в соединениях PH3, H2O, HBr. 3. Оксид трехвалентного металла содержит 31,58 % кислорода. Вычислите эквивалентную, мольную и атомную массы этого элемента. 4. Выразите в молях: а) 6,02 · 1022 молекул С2Н2; б) 1,80 · 1024 атомов азота; в) 3,01 · 1023 молекул аммиака. Какова мольная масса указанных веществ? 5. Вычислите эквивалент и эквивалентную массу фосфорной кислоты в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата. 6. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквивалентные массы металла и его оксида. Чему равны мольная и атомная массы этого металла? 7. Напишите уравнения реакций Fe(OH)3 с соляной кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидроксожелеза; в) трихлорид железа. Вычислите эквивалент и эквивалентную массу Fe(OH)3 в каждой из этих реакций. 8. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и эквивалентные массы. 9. В каком количестве Cr(OH)3 содержится столько же эквивалентов, сколько в 174,96 г Mg(OH)2? 10. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите эквивалентные массы металла и его оксида. Чему равны мольная и атомная массы металла? 11. Вычислите объем: а) 100 г водорода; б) 250 г азота при н.у. Вычислите массу аммиака NH3 количеством вещества 1,5 моль. (25,5 г) 12. Вычислите массу углекислого газа СО2 количеством вещества 0,5 моль. 13. Вычислите массу (г) указанных объемов газообразных веществ (при н.у.) а) 200 мл оксида углерода (II); б) 400 л водорода Н2; в) 2 л азота N2 14. Сколько моль эквивалентов содержится в 100 г карбоната кальция? 15. Определите массу 3 молей эквивалентов гидроксида натрия. 16. Сколько моль эквивалентов содержится в 10 г гидроксида бария? Какой объем занимает 0,2 моль эквивалентов водорода (при н.у.)? 17. При сгорании 1,5 г металла получилось 2,1 г оксида. Рассчитайте молярную массу эквивалента оксида этого металла. 18. Хлорид металла содержит 69% хлора. Вычислите молярную массу эквивалента металла. 19. Некоторое количество металла, молярная масса эквивалента которого равна 27,9 г/моль, вытесняет 0,7 л водорода (н.у). Определите массу металла. 20. Металл массой 1 г соединяется с 8,89 г брома и 1,78 г серы. Определите молярную массу эквивалента металла.
Раздел 2. Термодинамика химических превращений 21. Вычислите, какое количество теплоты выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. 22. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом исходя из термохимических уравнений FeO (к) + CO (г) = Fe (к) + CO2 (г); ∆H = –13,18 кДж. CO (г) + ½ O2 (г) = CO2 (г); ∆ H = –283,0 кДж. H2 (г) + ½ O2 (г) = H2O (г); ∆ Н = –241,83 кДж. 23. При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерода CS2 (г). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. 24. Напишите термохимическое уравнение реакции между CO (г) и водородом, в результате которой образуются CH4 (г) и H2O (г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия? 25. Тепловой эффект какой реакции равен теплоте образования NO? Вычислите теплоту образования NO исходя из следующих термохимических уравнений: 4NH3 (г) + 5О2 (г) = 4NO (г) + 6H2O (ж); ∆ H = –1168,80 кДж. 4NH3 (г) + 3О2 (г) = 2N2(г) + 6H2O (ж); ∆ H = 1530,28 кДж. 26. Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана исходя из следующих термохимических уравнений: H2 (г) + ½О2 (г) = H2O (ж); ∆H = –285, 84 кДж. С (к) + О2 (г) = CO2 (г); ∆H = –393,51 кДж. CH4 (г) + 2О2 (г) = 2H2O (ж) + CO2 (г); ∆H = –890, 31 кДж. 27. Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция исходя из следующих термохимических уравнений: Са (к) + ½О2 (г) = СаО (к); ∆H = –635,60 кДж. Н2 (г) + ½О2 (г) = Н2О (ж); ∆H = –285,84 кДж. CaO (к) + Н2О (ж) = Ca (OH) 2 (к); ∆H = –65, 06 кДж. 28. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен –3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж). 29. При взаимодействии 6,3 г железа с серой выделилось 11,31 кДж теплоты. Вычислите теплоту образования сульфида железа FeS. 30. При сгорании 1 л ацетилена (н.у.) выделяется 56,053 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н2 (г). 31. Реакция горения этилового спирта выражается термохимическим уравнением: Вычислить тепловой эффект реакции, если известно, что мольная теплота парообразования равна ( + 42,36 кДж) и известны теплоты образования. 32. Значения энтальпии растворения в воде составляют соответственно (-25,10 и + 66,94 кДж). Вычислите энтальпию гидратации. 33. Найдите теплоту сгорания алмаза, если стандартная теплота сгорания графита составляет -393,51 кДж, а теплота фазового перехода равна + 1,88 кДж. 34. Вычислите, какое количество теплоты выделится при восстановлении металлическим алюминием, если было получено 335,1 г железа. 35. Теплота растворения равна +8.66 кДж/моль, а теплота гидратации этой соли при переходе в составляет +29,16 кДж/моль. Какова теплота растворения? 36. Вычислите хлорида аммония, если для реакции = -176,93 кДж/моль. 37. При растворении 16 г в воде выделяется 31,3 кДж теплоты. Определите стандартную теплоту образования. 38. Какое количество теплоты выделяется при превращении 1 кг красного фосфора в черный, если = -18,41 кДж/моль; = -43,20 кДж/моль? 39. При сгорании 9,3 г фосфора выделяется 229,5 кДж теплоты. Рассчитайте оксида фосфора (V). 40. Сколько теплоты выделится при разложении 54 г глюкозы по реакции, если = -1273,0 кДж/моль; = -393,5 кДж/моль.
Раздел 3. Кинетика химических процессов. Химическое равновесие 41. Напишите выражение для константы равновесия гомогенной системы N2 + 3H2 D 2NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в 3 раза? 42. Реакция идет по уравнению N2 + 3H2 = 2NH3. Концентрации участвующих в ней веществ такие: [N2] = 0,80 моль/л; [H2] = 1,5 моль/л; [NH3] = 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/л. 43. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 °С. Температурный коэффициент скорости реакции 3. 44. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 °С, если температурный коэффициент скорости данной реакции 2? 45. Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O = 2N2 + O2, равна 5 ∙ 10- 4. Начальная концентрация N2O = 6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда разложится 50 % N2O. 46. Напишите выражение для константы равновесия гетерогенной системы CO2 + C D 2CO. Как изменится скорость прямой реакции – образования CO, если концентрацию CO2 уменьшить в 4 раза? Как следует изменить давление, чтобы повысить выход CO? 47 Напишите выражение для константы равновесия гетерогенной системы C + H2O (г) D CO + H2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров? 48. Вычислите константу равновесия для гомогенной системы СО (г) + Н2О (г) D СО2 (г) + Н2 (г), если равновесные концентрации реагирующих веществ [CO]p = 0,004 моль/л; [H2O]p = 0,064 моль/л; [CO2]p = 0,016 моль/л; [H2]p = 0,016 моль/л. Чему равны исходные концентрации воды и СО? 49. Константа равновесия гомогенной системы следующая: CО (г) + H2O (г) D CO2 + H2 (г). При некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации следующие: [CO]исх = 0,10 моль/л; [H2O]исх = 0,4 моль/л. 50. При некоторой температуре равновесие гомогенной системы 2NO + O2 D 2NO2 установилось при таких концентрациях реагирующих веществ: [NO]p = 0,2 моль/л; [O2]p = 0,1 моль/л; [NO2]p = 0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NO и O2. 51. Во сколько раз изменится скорость химической реакции при увеличении температуры от 300 до 350 К, если температурный коэффициент g = 3? 52. На сколько нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 3. 53. Определите температурный коэффициент скорости реакции, если при понижении температуры на 400 реакция замедлилась в 16 раз. 54. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость возрастает в 15,6 раза? 55. Температурный коэффициент скорости некоторой реакции равен 2,0. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 50 градусов? 56. При синтезе аммиака при некоторых условиях в равновесии находятся 0,1 моль/л N2; 0,2 моль/л H2 и 0,8 моль/л NH3. Вычислите константу равновесия и рассчитайте исходные концентрации азота и водорода. 57. Напишите выражение констант равновесия следующих обратимых химических реакций: а) 2NO + O2 « 2NO2; б) C + CO2 « 2CO; в) 4HCl + O2 « 2H2O + 2Cl2. 58. Составьте выражение констант равновесия для следующих процессов: а) PCl3(ж) + Cl2(г) « PCl5(к); б) 3Fe(к) + 4H2O(г) « Fe3O4(к) + 4H2(г); в) CH4(г) + I2(г) « CH3I(ж) + HI(г). 59. В каком направлении сместятся равновесия: 2CO(г) + O2(г) « 2CO2(г); DH2980 = –566 кДж; N2(г) + O2(г) « 2NO(г); DH0 = 180 кДж. а) при понижении давления? б) при повышении давления? 60. При синтезе аммиака при некоторых условиях в равновесии находятся 0,1 моль/л N2; 0,2 моль/л H2 и 0,8 моль/л NH3. Вычислите константу равновесия и рассчитайте исходные концентрации азота и водорода.
Раздел 4. Химические системы: растворы 61. Чему равна нормальность 30%-го раствора NaOH плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора. 62. К 3 л 10%-го раствора HNO3 плотностью 1,054 г/см3 прибавили 5 л 2%-го раствора той же кислоты плотностью 1,009 г/см3. Вычислите процентную и молярную концентрации полученного раствора, объем которого равен 8 л. 63. Вычислите эквивалентную и моляльную концентрации 64. Какой объем 20,01%-го раствора HCl (ρ = 1,100 г/см3) требуется для приготовления 1 л 10,17%-го раствора (ρ = 1,050 г/см3)? 65. Какой объем 50%-го раствора КОН (ρ = 1,538 г/см3) требуется для приготовления 3 л 6%-го раствора (ρ = 1,048 г/см3)? 66. Какой объем 0,3 н раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3? 67. Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н раствора NaOH? 68. Смешали 300 г 20%-го раствора и 500 г 40%-го раствора NaCl. Чему равна процентная концентрация полученного раствора? 69. Из 700 г 60%-й серной кислоты выпариванием удалили 200 г воды. Чему равна процентная концентрация оставшегося раствора? 70. Из 10 кг 20%-го раствора при охлаждении выделилось 400 г соли. Чему равна процентная концентрация охлажденного раствора? 71. В каком объеме 1 М раствора и в каком объеме 1 н раствора содержится 114 г Al2(SO4)3? 72. До какого объема надо разбавить 500 мл раствора хлорида натрия с массовой долей NaCl 20 % (r = 1,125 г/см3), чтобы получить раствор с массовой долей NaCl 5 % (r = 1,03 г/см3)? 73. Из 400 г раствора с массовой долей растворенного вещества 20 % при охлаждении выделилось 50 г растворенного вещества. Чему равна массовая доля вещества в оставшемся растворе? 74. Сколько молей гидроксида калия содержится в 5 л раствора с массовой долей KOH 20 % (r = 1,24 г/см3)? 75. Какую массу оксида серы (VI) надо растворить в 400 г H2O, чтобы получить раствор серной кислоты с массовой долей H2SO4, равной 15 %? 76. Какой объем 0,1 М раствора ортофосфорной кислоты можно приготовить из 75 мл 0,75 н раствора? 77. Чему равна молярная концентрация эквивалента раствора с массовой долей NaOH 30 % (r = 1,328 г/см3). К 1 л этого раствора добавили 1 л воды. Какова процентная концентрация полученного раствора? 78. Водный раствор содержит 435 г H2SO4 в 1 л раствора (r = 1,310 г/см3). Вычислите массовую долю (%) серной кислоты в растворе, а также молярную и нормальную концентрацию раствора. 79. Какую массу Na2SO4×10H2O нужно взять для приготовления 2 кг раствора с массовой долей Na2SO4 10 %? 80. Найти массовую долю (%) раствора азотной кислоты, в 1 л которого содержится 224 г HNO3 (r = 1,12 г/см3).
Раздел 5. Свойства растворов электролитов. Реакции в растворах электролитов 81. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а)NaHCO 3и NaOH; б) K2SiO3 и HCl; в) BaCl2 и Na2SO4. 82. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2S и HCl; б) FeSO4 и (NH4)2S; в) Cr(OH)3 и KOH. 83. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а)CuSO4 и H2S; б) BaCO3 и HNO3; в) FeCl3 и KOH. 84. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а)Be(OH)2 и NaOH; б) Cu(OH)2 и HNO3; в) ZnOHNO3 и HNO3. 85. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Na3PO4 и CaCl2;б) K2CO3 и BaCl2; в) Zn(OH)2 и KOH. 86. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а)CdS и HCl;б) Cr(OH)3 и NaOH; в) Ba(OH)2 и CoCl2. 87. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а)FeCl3 и KOH;б) NiSO4 и (NH4)2S; в) MgCO3 и HNO3. 88. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а)Be(OH)2+2OH-= + 2H2O; б) CH3COO- + H+ = CH3COOH; в) Ba2+ + 89. Напишите в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: а) нитрат свинца и иодид калия; б) хлорид никеля и сероводородная кислота; в) карбонат калия и хлороводородная кислота; г) сульфат меди и гидроксид натрия; д) бромид алюминия и нитрат серебра. 90. Можно ли приготовить раствор, содержащий одновременно следующие пары веществ: а) Zn(OH)2 + KOH; б) Ba(OH)2 + HCl; в) Fe(OH)3 + NaOH. Представьте возможные реакции в молекулярном и молекулярно-ионном виде. 91. Напишите в молекулярной и молекулярно-ионной формах уравнения реакции взаимодействия следующих веществ: а) нитрата серебра и хлорида железа (II); б) карбоната кальция и хлороводородной кислоты; в) гидроксида бария и азотной кислоты. 92. Составьте по три молекулярных уравнения реакций к каждому из молекулярно-ионных уравнений: а) Ca2+ + CO32- = CaCO3¯; б) CO32- + 2H+ = CO2 + H2O; в) H+ + OH- = H2O. 93. Смешивают попарно растворы: а) Cu(NO3)2 и Na2SO4; б) BaCl2 и K2SO4; в) KNO3 и NaCl; г) AgNO3 и KCl; д) Ca(OH)2 и HCl. В каких из приведенных случаев реакции практически идут до конца? Составьте для этих уравнений молекулярные и молекулярно-ионные уравнения. 94. Можно ли приготовить раствор, содержащий одновременно следующие пары веществ: а) Zn(OH)2 + KOH; б) Ba(OH)2 + HCl; в) Fe(OH)3 + NaOH. Представьте возможные реакции в молекулярном и молекулярно-ионном виде. 95. Напишите в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссоциированных соединений: а) сульфид натрия и серная кислота; б) сульфид железа(II) и хлороводородная кислота; в) ацетат калия и азотная кислота; г) хлорид аммония и гидроксид кальция. 96. Составьте в молекулярной форме уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями: NO2- + H+ = HNO2; Cu2+ + 2OH- = Cu(OH)2¯; Pb2+ + 2I- = PbI2¯. 97. Напишите в молекулярной и ионно-молекулярной форме реакции взаимодействия между веществами: а) Na2S и FeSO4; б) Na2SO3 и HCl; в) CH3COOK и H2SO4; г) HgI2 и KI. 98. Дано краткое ионно-молекулярное уравнение CN- + H+ = HCN. Составьте по нему возможные молекулярные уравнения. 99. Смешивают попарно растворы: а) Cu(NO3)2 и NaОН; б) BaCl2 и K2SO4; в) AgNO3 и KBr.Составьте для этих уравнений молекулярные и молекулярно-ионные уравнения. 100. Напишите в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссоциированных соединений: а) сульфид натрия и серная кислота; б) сульфид железа(II) и хлороводородная кислота; в) ацетат калия и азотная кислота; г) хлорид аммония и гидроксид кальция.
Раздел 6. Гидролиз солей 101. К раствору FeCl3 добавили следующие вещества: а) HCl; б) KOH; в) ZnCl2; г) Na2CO3. В каких случаях гидролиз хлорида железа (III) усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. 102. Какие из солей Al(SO4)3, K2S, Pb(NO3)2, KCl подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение pH (>7<) имеют растворы этих солей? 103. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Pb(NO3)2, Na2CO3, Fe2(SO4)3. Какое значение pH (>7<) имеют растворы этих солей? 104. Какое значение pH (>7<) имеют растворы солей Na3PO4, K2S, CuSO4? Составьте ионно-молекулярные и молекулярные уравнения этих солей. 105. Какие из солей RbCl, Cr2(SO4)3, Ni(NO3)2, Na2SO3 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение pH (>7<) имеют растворы этих солей? 106. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2CO3 или Na2SO3; FeCl3 или FeCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 107. Какие из солей K2CO3, FeCl3, K2SO4, ZnCl2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение pH (>7<) имеют растворы этих солей? 108. Составьте ионно-молекулярное и молекулярное уравнения гидролиза соли, раствор которой имеет: а) щелочную реакцию; б) кислую реакцию 109. Какое значение PH (>7<) имеют растворы следующих солей: K3PO4, Pb(NO3)2, Na2S? Составьте ионно-молекулярные уравнения гидролиза этих солей. 110. Вычислите константу гидролиза хлорида аммония, определите степень гидролиза этой соли в 0,01 М растворе и pH раствора. 111. Какие из перечисленных ниже солей подвергаются гидролизу: NaCN, KNO3, KOCl, NaNO2, NH4CH3COO, CaCl2, NaClO4, KHCOO, KBr? Для каждой из гидролизующихся солей напишите уравнение гидролиза в ионно-молекулярной форме и укажите реакцию ее водного раствора. 112. Укажите, какие из перечисленных ниже солей подвергаются гидролизу: а) ZnBr2, K2S, Fe2(SO4)3, MgSO4; б) KNO3, K2CO3, Na3PO4, CuCl2. Для каждой из гидролизующихся солей напишите в молекулярной и ионно-молекулярной форме уравнения гидролиза по каждой ступени, укажите реакцию водного раствора соли. 113. Определите концентрации ионов H+ и OH- в растворах, водородный показатель которых равен 3,0; 5,8; 9,0; 11,5. 114. Какие из солей подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение имеют растворы этих солей? 115. К раствору добавили следующие вещества. В каких случаях гидролиз cульфата никеля усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. 116. Составьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивании растворов. Каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. 117. Какое значение имеют растворы солей ? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 118. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей. Какое значение имеют растворы этих солей? 119. Какое значение имеют растворы солей ? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 120. Какая из двух солей при равных условиях в большей степени подвергается гидролизу? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
Раздел 7. Окислительно-восстановительные реакции 121. Исходя из степени окисления элементов в молекулах реагирующих соединений определите, какое вещество является окислителем, какое – восстановителем. На основании ионно-электронного баланса расставьте коэффициенты в уравнениях окислительно-восстановительной реакции: P + HNO3 + H2O → H3PO4 + NO KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O 122. Исходя из степени окисления хрома, йода и серы в соединениях K2Cr2O7, KI и H2SO3 определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме NaCrO2 + PbO2 + NaOH → Na2CrO4 + Na2PbO2 + H2O 123. Задание см. 121. H2S + Cl2 + H2O → H2SO4 + HCl K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O 124. Задание см. 121. P + HClO3 + H2O → H3PO4 + HCl H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + MnSO4 + K2SO4 + H2O 125. Задание см. 121. NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O FeS + HNO3 → Fe(NO3)2 + S + NO + H2O 126. Могут ли происходить окислительно-восстановительные реакции между веществами: а) NH3 и KMnO4; б) HNO2 и HI; в) HCl и H2Se? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O 127. Задание см.121. HCl + CrO3 → Cl2 + CrCl3 + H2O Cd + KMnO4 + H2SO4 → CdSO4 + MnSO4 + K2SO4 + H2O 128. Задание см. 121. Cr2O3 + KClO3 + KOH → K2CrO4 + KC l + H2O MnSO4 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + PbSO4 + H2O 129. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях: As 3– → As 5+; N 3+ → N 3– ; S 2– → S 0 На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH 130. Задание такое же, как в задаче 121. K2Cr2O7 + HC l → C l 2 + CrCl3 + KC l + H2O; Au + HNO3 + HCl → AuCl3 + NO + H2O. 131. Исходя из степени окисления фосфора в соединениях PH3, H3PO4, H3PO3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании ионно-электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме PbS + HNO3 → S + Pb(NO3)2 + NO + H2O. 132. Исходя из степени окисления элементов в молекулах реагирующих соединений, определите, какое вещество является окислителем, какое – восстановителем. На основании ионно-электронного баланса расставьте коэффициенты в уравнениях окислительно-восстановительной реакции: P + HNO3 + H2O → H3PO4 + NO; KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O. 133.Задание такое же, как в задаче 121. HNO3 + Ca → NH4NO3 + Ca(NO3)2 + H2O; K2S + KMnO4 + H2SO4 → S + K2SO4 + MnSO4 + H2O. 134. Исходя из степени окисления хрома, йода и серы в соединениях K2Cr2O7, KI и H2SO3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании ионно-электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме NaCrO2 + PbO2 + NaOH → Na2CrO4 + Na2PbO2 + H2O. 135. Задание такое же, как в задаче 132. H2S + Cl2 + H2O → H2SO4 + HCl; K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O. 136. Задание такое же, как в задаче 132. P + HClO3 + H2O → H3PO4 + HCl; H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + MnSO4 + K2SO4 + H2O. 137. Задание такое же, как в задаче 132. NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O; FeS + HNO3 → Fe(NO3)2 + S + NO + H2O. 138. Задание такое же, как в задаче 132. HNO3 + Zn → N2O + Zn(NO3)2 + H2O; FeSO4 + KC l O3 + H2SO4 → Fe2(SO4)3 + KC l + H2O. 139. Задание такое же, как в задаче 132. K2Cr2O7 + HC l → C l 2 + CrCl3 + KC l + H2O; Au + HNO3 + HCl → AuCl3 + NO + H2O. 140. Могут ли происходить окислительно-восстановительные реакции между веществами: а) NH3 и KMnO4; б) HNO2 и HI; в) HCl и H2Se? Почему? На основании ионно-электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O.
Раздел 8. Электрохимические системы. 141. Определите значение электродного потенциала меди, погруженной в 0,0005 н Сu(NO3)2. 142. Вычислите потенциал водородного электрода, если СН+ в растворе равна 3,8×10-3 моль/л. 143. Вычислите потенциал железного электрода, опущенного в раствор, содержащий 0,0699 г FeCl2 в 0,5 л. 144. Потенциал водородного электрода равен –0,145 В. Определите рН раствора и активность ионов водорода в растворе. Коэффициент активности иона Н+ равен 0,975. 145. Вычислите потенциал водородного электрода при рН = 5 и стандартном давлении. 146. Потенциал кадмиевого электрода при 298 K в растворе его соли равен 0,52 В. Рассчитайте активность ионов кадмия. 147.При какой активности ионов РЬ2+ равновесный потенциал свинцового электрода при 298 K будет равен стандартному потенциалу никелевого электрода? 148. Рассчитайте потенциал электрода, на котором при 298 K установилось равновесие Cl2 + 2e « 2Cl- при = 10 и = 10-2 моль/л, Е0 = +1,36. 149. Рассчитайте потенциал электрода, на котором при 298 K установилось равновесие F2 + 2e « 2F- при стандартном давлении и активности ионов фтора, равной 10-3моль/ л, Е0 = +2,84 В. 150. Рассчитайте электродные потенциалы магния в растворе его соли при концентрациях иона магния 0.1, 0,01 и 0,001 моль/л. 151. Что является окислителем и восстановителем в гальваническом элементе, составленном из олова и меди, которые погружены в 1 М растворы их солей? Составьте схему и напишите электродные процессы гальванического элемента. Рассчитайте ЭДС. 152. Что является окислителем и восстановителем в гальваническом элементе, составленном из свинца и железа, которые погружены в 0,005 М растворы их солей? Составьте схему и напишите электродные процессы гальванического элемента. Рассчитайте ЭДС. 153. Какие процессы происходят у электродов медного концентрационного гальванического элемента, если у одного из электродов концентрация ионов Cu2+ (моль/л) равна 1,0, а у другого – 10-3? Составьте схему данного элемента. 154. Составьте схемы двух гальванических элементов, в одном из которых кадмий является анодом, а в другом – катодом. Напишите уравнения электродных процессов и вычислите ЭДС каждого элемента. 155. Составьте схемы, напишите уравнения электродных процессов и суммарной реакции элемента, один из электродов которого Fe3+ïFe2+, а второй Cr3+ïCr2+, при активностях всех ионов, равных 0,1 моль/л. Рассчитайте ЭДС этого элемента. 156. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде. 157. Составьте схемы, напишите уравнения электродных процессов элемента, состоящего из серебряной и свинцовой пластин, опущенных в раствор, содержащий собственные ионы с аAg+ = аPb2+ = 1,0 моль/л. Рассчитайте ЭДС этого элемента. Изменится ли ЭДС, если активности ионов уменьшатся в 10 раз? 158. Составьте схемы, напишите уравнения электродных процессов элемента, состоящего из медной и кадмиевой пластин, опущенных в раствор, содержащий собственные ионы с аCd2+ = аCu2+ = 0,1 моль/л. Рассчитайте ЭДС этого элемента. Изменится ли ЭДС, если активность ионов возрастет в 10 раз? 159. Составьте схемы двух гальванических элементов, в одном из которых медь является анодом, а в другом – катодом. Напишите уравнения реакций, происходящих при работе этих элементов, и вычислите значения стандартных ЭДС. 160. Составьте схемы, напишите уравнения электродных процессов и суммарной реакции элемента, у которых один электрод серебряный, погруженный в 1 М раствор AgNO3, а второй стандартный водородный. Рассчитайте ЭДС этого элемента.
Раздел 9. Электролиз 161. Электролиз раствора сульфата некоторого металла проводили при силе тока в 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалентную массу металла. 162. Электролиз раствора сульфата цинка проводили в течение 163. При электролизе соли трехвалентного металла при силе тока 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислите атомную массу металла. 164. При электролизе растворов MgSO4 и ZnCl2, соединенных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Какая масса вещества выделится на другом катоде; на анодах? 165. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора Na2SO4. Вычислите массу вещества, выделяющегося на катоде, если на аноде выделяется 1,12 л газа (н.у.) Какая масса H2SO4 образуется при этом возле анода? 166. При электролизе соли некоторого металла в течение 1,5 ч при силе тока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислите эквивалентную массу металла. 167. При электролизе раствора CuSO4 на аноде выделилось 168 см3 газа (н.у.). Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде. 168. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора AgNO3. Если электролиз проводить с серебряным анодом, то его масса уменьшается на 5,4 г. Определите расход электричества при этом. 169. Напишите уравнения реакций, протекающих на графитовых электродах при электролизе: а) расплава хлорида магния, б) раствора хлорида магния. Сколько времени необходимо вести электролиз при силе тока 2 А, чтобы на катоде выделилось вещество массой 2,43 г (для реакций а и б)? 170. Через раствор сульфата кадмия пропущено 25 А×ч электричества. При этом на катоде выделился кадмий массой 42,5 г. Напишите уравнения реакций, протекающих на электродах, рассчитайте выход по току кадмия. 171. При пропускании тока 2А в течение 1 ч 14 мин 24 с через водный раствор хлорида металла (II) на одном из графитовых электродов выделился металл массой 2,94 г. Чему равна атомная масса, если выход по току 100 %, и что это за металл? Напишите уравнения реакций, протекающих на электродах. 172. Через раствор сульфата кадмия пропущено 25 А×ч электричества. При этом на катоде выделился кадмий массой 42,5 г. Напишите уравнения реакций, протекающих на электродах, рассчитайте выход по току кадмия. 173. Напишите уравнения реакций, протекающих на графитовых электродах при электролизе: а) расплава хлорида магния, б) раствора хлорида магния. Сколько времени необходимо вести 174. При электролизе сульфата натрия получили при н.у. Н2 объемом 448 л. Напишите уравнения реакций, протекающих на нерастворимых аноде и катоде, и рассчитайте, сколько времени протекал электролиз, если сила тока была 100 А. 175. Электролиз раствора K2SO4 проводили с нерастворимыми электродами при токе 2,68 А в течение 1 ч. Составьте уравнения процессов, происходящих на электродах, вычислите объем выделяющихся при н.у. на электродах веществ. 176. При электролизе раствора сульфата меди на аноде выделился кислород объемом 560 мл, измеренный при н.у. Сколько граммов меди выделилось на катоде? 177. Напишите уравнения реакций, протекающих на электродах при электролизе водного раствора сульфата кадмия: а) с графитовым анодом, б) с кадмиевым анодом. Если через раствор пропускать ток 134 А в течение 2 ч, то как изменится количество кадмия в растворе в обоих случаях, если выход по току кадмия на катод равен 80 %, а на аноде – 100 %? 178. Напишите уравнения реакций, протекающих на нерастворимых электродах при электролизе водного раствора КОН. Какие вещества и в каком объеме можно получить при н.у., если пропустить ток 13,4 А в течение 2 ч? 179. Сколько граммов Н2SO4 образуется около нерастворимого анода при электролизе раствора Na2SO4, если на аноде выделяется кислород объемом 1,12 л, измеренный при н.у. Вычислите массу вещества, выделяющегося на катоде. 180. Напишите уравнения реакций, протекающих на графитовом электроде при электролизе а) расплава хлорида кальция, б) раствора хлорида кальция. Сколько времени необходимо вести электролиз при токе 1 А, чтобы на катоде выделилось вещество массой 4 г (для случаев а и б).
Раздел 10. Коррозия металлов и методы защиты от коррозии 181. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов. 182. Железное изделие покрыли никелем. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях? 183. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний – никель. Какие продукты коррозии образуются в первом и втором случаях? 184. Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде. 185. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары алюминий – железо. Какие продукты коррозии образуются в первом и во втором случаях? 186. Как влияет pH среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов. 187. Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником? 188. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов. 189. В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов. 190. Какое покрытие металла называют анодным и какое –катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и в кислой среде. 191. Как происходит атмосферная коррозия луженого (покрытого слоем олова) и оцинкованного железа при нарушении сплошности покрытия? Составьте уравнения анодного и катодного процессов. 192. Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Объясните это явление, составив уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции. 193. Как происходит атмосферная коррозия луженого (покрытого слоем олова) железа и луженой меди при нарушении покрытия? Составьте уравнения анодного и катодного процессов. 194. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте уравнения анодного и катодного процессов. 195. В раствор соляной кислоты поместили две цинковые пластинки, одна из которых частично покрыта никелем. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив уравнения соответствующих процессов. 196. При работе гальванического элемента (–) 4Al ½ 4Al3+½ Н2О, О2 ½ (Сr) 12ОН- ½ 6Н2О, 3О2 (+), образовавшегося при коррозии алюминия, который находится в контакте с хромом, за 1 мин 20 с его работы на хромовом катоде восстановилось 0,034 л кислорода. Определите, насколько уменьшилась масса алюминиевого электрода и чему равна сила тока, протекающего во внешней цепи гальванического элемента. 197. Железное изделие покрыли цинком. Какое это покрытие – анодное или катодное? Почему? Составьте уравнения анодного и катодного процессов коррозии этого изделия при нарушении цельности покрытия во влажном воздухе и в растворе соляной кислоты. Какие продукты коррозии образуются в первом и во втором случаях? 198. Железное изделие покрыли свинцом. Какое это покрытие – анодное или катодное? Почему? Составьте уравнения анодного и катодного процессов коррозии этого изделия при нарушении цельности покрытия во влажном воздухе и в растворе соляной кислоты. Какие продукты коррозии образуются в первом и во втором случаях? 199. Какой металл может служить протектором при защите железа от коррозии в водном растворе с рН 10 в контакте с воздухом? Напишите уравнения реакций протекающих процессов. 200. Медь покрыта оловом. При нарушении оловянного покрытия работает гальванический элемент (–) Sn ½ Sn2+½ НС1 ½ (Сu) Н2 ½ 2Н+ (+), который дает ток силой 7,5 А. Какая масса хрома окислится и сколько литров водорода выделится на медном катоде за 25 мин?
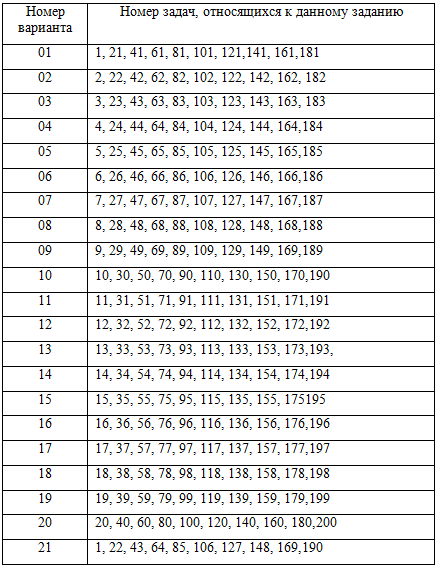
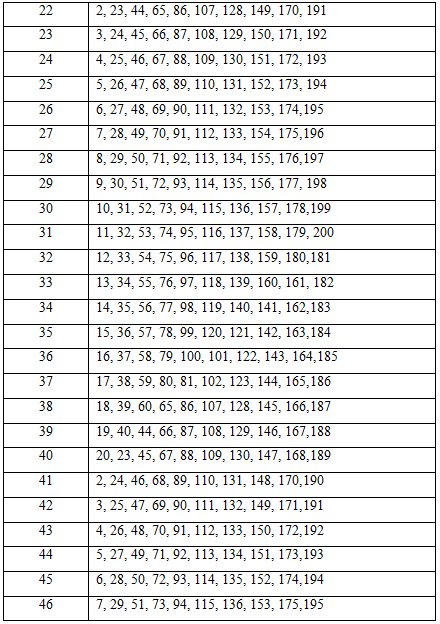
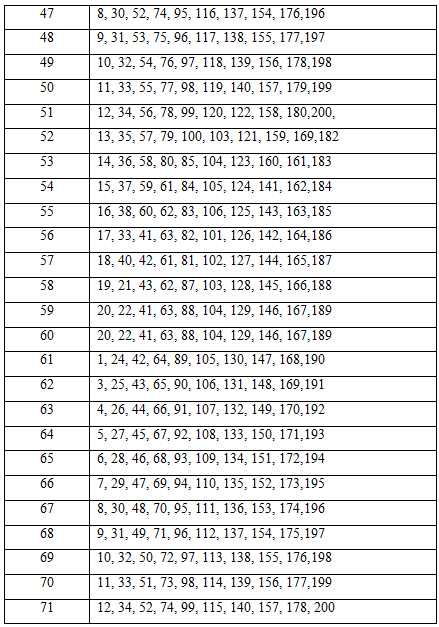
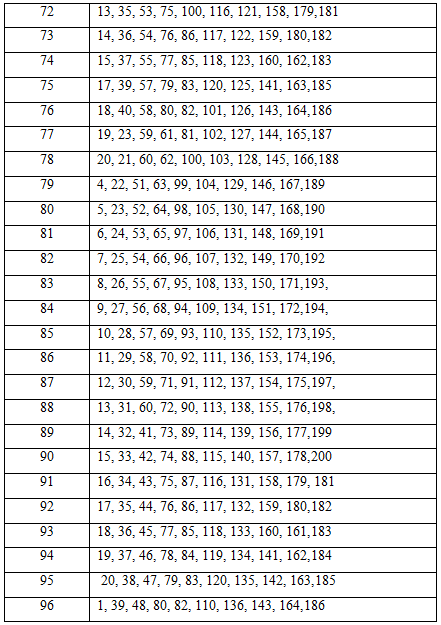
Таблица вариантов заданий для контрольной работы
| |