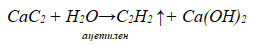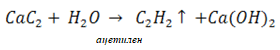| Общая информация » Каталог студенческих работ » ЕСТЕСТВЕННЫЕ ДИСЦИПЛИНЫ » Химия |
| 23.11.2017, 12:46 | |
Вариант контрольного задания выбирается в соответствии с двумя последними цифрами зачетной книжки студента. Тема 1 КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ 1. а) Определить тип соли, дать название каждой. Выписать кислотные остатки, указав степень их окисления: Cr(NO3)3, Mg(HCO3)2, Al2(SO4)3, FeOHCl2. б) Составить несколько уравнений получения карбоната магния. 2. а) Определить среди приведенных оксидов кислотные: CuO, P2O5, SiO2, Na2O, Al2O3, Mn2O7. Написать формулы соответствующих им гидратов. Составить уравнения химических реакций, характерных для кислотных оксидов. б) Составить уравнения реакций, с помощью которых можно осуществить следующие превращения: CuSO4→Cu(OH)2→CuO→CuCO3→CuO→Cu. 3. а) Составить формулы гидроксидов, соответствующих следующим оксидам: оксид меди (II), оксид фосфора (V), оксид кремния (IV), оксид натрия, оксид хрома (VI). б) Какие из приведённых веществ реагируют с гидроксидом натрия: BaSO4, HNO3, CO2, AlCl3, Zn(OH)2, CaO? Составить уравнение реакций. 4. а) Какой из приведенных оксидов соответствует марганцовой кислоте KMnO4: MnO2, MnO3, Mn2O7, Mn2O3? Ответ обосновать. Каков характер этого оксида? б) Составить уравнения, с помощью которых можно осуществить следующие превращения: Al→Al2O3→AlCl3→Al(OH)3→NaAlO2. 5. а) Какая из приведенных кислот хлора не имеет ангидрида (кислотного оксида): HClO3, HClO2, HCl, HClO4. Ответ обосновать. Дать названия всем кислотам и их солям. б) Составить формулы всех возможных солей металла магния и ортофосфорной кислоты. Дать им названия. 6. а) Написать уравнения реакций, с помощью которых можно осуществить следующие превращения: Pb→Pb(NO3)2→Pb(OH)2→PbOHCl→PbCl2. Дать названия полученным веществам. б) Составить уравнения химических реакций, доказывающих амфотерные свойства гидроксида алюминия. 7. а) Закончить уравнения реакций. Какая из них является реакцией нейтрализации? CuSO4 + NaOH→; SO2 + H2O→; Ba(OH)2+ HNO3→; P2O5 + NaOH→; б) Составить химические формулы соединений, исходя из их названия: оксид серы (VI), сульфат хрома (III), гидрокарбонат магния, гидроксид железа (III), оксид титана (IV), дигидроксокарбонат аммония. 8. а) Поверхность металла перед пайкой или сваркой обрабатывают кислотой (процесс «травления»). Зачем? Составить уравнение протекающей при этом реакции. б) Составить уравнения реакций, с помощью которых можно осуществить следующие превращения: Cu→CuO→CuCl2→Cu(OH)2→CuSO4→Cu 9. а) Цинк растворяется в воде только в присутствии щелочи. Почему? Составить уравнения протекающих при этом реакций. б) Какая из кислот серы не имеет оксида: H2SO3, H2S, H2SO4? Почему? Для остальных кислот составить формулы их оксидов. 10. а) Какие вещества можно получить из реактивов: оксид цинка, соляная кислота, оксид серы (IV), цинк, едкий натр (щелочь)? Составить уравнения реакций. б) Распределить вещества по классам химических соединений, дать им названия: Fe(OH)2, H3BO3, NaHS, CrOHCl2, BaO, Al2(SO4)3. 11. а) указать кислотный остаток и степень окисления его для следующих соединений: Cr(NO3)3, Ca(HS)2, FeCl3, (MgOH)3PO4, Na2ZnO2. Дать названия соединениям. б) Закончить уравнения реакций: K2CO3 + H2SO4→; Al(OH)3 + NaOH→; Mg + HCl→; SO3 + CaO→; CuOHCl + HCl→. 12. а) Составить уравнения реакций, при помощи которых можно получить: гидроксид меди (II), гидрокарбонат натрия, серную кислоту и ее соль. б) Написать формулы оксидов, соответствующих следующим гидроксидам: Be(OH)2, HClO4, KOH, HNO2. Дать названия оксидам. 13. а) Какие из приведенных оксидов реагируют с соляной кислотой: SO3, CaO, Na2O, N2O5? Составить уравнения реакций взаимодействия. Какие свойства – кислотные или основные – характерны для этих оксидов? б) Составить не менее 6 уравнений реакций получения солей различными способами. Дать названия полученным веществам. 14. а) С помощью каких реакций можно осуществить следующие превращения: оксид бария → гидроксид бария → гидрокарбонат бария → карбонат бария → оксид бария. б) Составить формулы веществ по их названиям, указать, к какому классу химических веществ они принадлежат: хромат свинца (II), оксид хлора (V), ортофосфат калия, гидроксид марганца (IV), гидросульфит натрия. 15. а) Классифицируйте приведенные оксиды по их свойствам: SiO2, MgO, CrO3, P2O5, Al2O3. Ответ обосновать соответствующими уравнениями реакций. б) Оксид натрия растворили в воде и пропустили через раствор углекислый газ. В результате нейтрализации образуется кислая соль. Составьте уравнения протекающих реакций. 16. а) При пропускании оксида углерода (IV) через раствор гидроксида бария получили гидрокарбонат бария, который при прокаливании превращается в карбонат бария. Составить уравнения реакций. б) В двух склянках находятся сухие соли: хлорид натрия и карбонат натрия. При помощи какого одного реактива можно распознать эти вещества. Составить уравнение реакции. 17. а) Какие соли фосфорной кислоты можно получить при ее взаимодействии с гидроксидом калия в следующих соотношениях: H3PO4 + 2KOH→; H3PO4 + KOH→; H3PO4 + 3KOH→. Дать названия солям. б) Привести примеры реакций, доказывающие основной характер оксида магния и его гидроксида. 18. а) Осуществить превращения: Fe(NO3)3→Fe(OH)3→Fe2O3→Fe→FeCl3. б) Определить класс следующих веществ: Ba(HS)2, HNO2, AlBr3, (CuOH)2CO3 и дать им названия. 19. а) Составить не менее 4 реакций получения карбоната кальция. б) В двух пробирках находятся сухие вещества: оксид кальция и оксид фосфора (V). При помощи каких реагентов можно различить эти вещества? Составить уравнения реакций. 20. а) С помощью каких реакций можно получить ортофосфат кальция из простых веществ: кальция, фосфора и кислорода? Составить уравнения реакций. б) Какие вещества образуются при прокаливании: карбоната и гадрокарбоната кальция? Составить уравнения реакций. 21. а) Написать уравнения реакций получения гидроксохлорида меди (II), гидросульфита калия. б) Закончить уравнения реакций и назвать полученные продукты: Fe2O3 + H2SO4→; N2O5 + Ba(OH)2→; SO3 + H2O→; ZnO + KOH→. 22. а) С какими из веществ реагирует оксид углерода (IV): MgO, NaCl, ZnO, AgNO3, N2O5. Составить уравнения реакций. б) Написать уравнения реакций получения гидроксида цинка, если исходным веществом является оксид цинка. 23. а) Составить уравнения реакций следующих превращений: Al → Al2O3 → AlCl3 → Al(OH)3 → Al2O3 → KAlO2. б) Как из известняка, содержащего карбонат кальция, и соляной кислоты, не расходуя других веществ, получить новые вещества? Составить уравнения реакций. 24. а) Составить уравнения реакций следующих превращений: C→CO2→Ca(HCO3)2→CaCO3→CO2 б) Медные изделия со временем покрываются на воздухе зеленым налетом за счет образования гидроксокарбоната меди. Составить уравнение реакции его образования 25. а) Минерал малахит – основная соль меди и угольной кислоты – при прокаливании изменяет свою зеленую окраску на белую. Почему? Составить уравнение реакции. б) Гидроксид хрома (III) растворяется в растворах кислоты и щелочи? Почему? Составить уравнения соответствующих реакций.
Тема 2 ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ 26. Жидкий кислород перевозят в транспортных ёмкостях, вмещающих 3,2 т кислорода. Какой объем при и.у. занимает такое количество газообразного кислорода? 27. При разложении бертолетовой соли KClO3 образуется кислород .Какой объем кислорода при н.у. можно получить при разложении 1 моля соли? 28. Какой объем водорода при н.у. выделится при растворении в воде 1 моль любого щелочного металла? 29. Качество карбида кальция CaC2 определяется литражом –объемом газа при н.у.,образуещегося при действии воды на 1 кг карбида:
Каков литраж химически чистого карбида, если взять 2,16 кг технического с 80 %-ым содержанием чистого вещества? 30. Карбид кальция поставляется потребителям в барабанах, вмещающих 130 кг. Какой объем ацетилена при н.у. можно получить из 80 %-го технического карбида при действии на него водой?
31. Сколько грамм алюминия потребуется, чтобы растворить в щёлочи NaOH и получить 336 лводорода? Составить уравнение реакции. 32. Сколько граммов оксида алюминия образуется при восстановлении 800 г Fe2O3 алюминия? 33. Сколько литров воздуха требуется для сжигания 30 г магния, принимая содержание кислорода в воздухе равным 21%? 34. Сколько молей железа в килограммовой гири, если она изготовлена из чугуна, содержащего 95% железа? Какова масса этого количества молей Fe? 35. При прокаливании гидроксида железа (III) получают коричневую краску железной сурик. Сколько кг этого гидроксида требуется для получения 8 кг сурика? 36. Сколько граммов ортофосфорной кислоты получится при растворении 284 г оксида фосфора (V)? Сколько молей щёлочи NaOH потребуется для её нейтрализации? 37. Человек выдыхает в сутки до 1300 г углекислого газа. Какой объем при н.у. занимает такое количество углекислого газа? Чему равен его объём при температуре 20 0С и нормальном давлении? 38. На сжигание 1.5 г двухвалентного металла требуется 0,69 л кислорода при н.у. Рассчитать эквивалентную массу металла и определить металл. 39. Какой объем занимает 0,1 моль оксида азота (V). Сколько молекул находится в этом объёме? Какова масса одной молекулы? 40. Вычислить атомную массу двухвалентного металла, если известно, что при взаимодействии 4г металла с кислотой выделилось 2,24 литра водорода при н.у. 41. Какой объем кислорода при н.у выделится при разложении, бертолетовой соли KClO3 массой 1,225 г, если при этом образовалось 0,745 г хлорида калия? 42. Оксид металла (III) содержит по массе 70% металла. Найти эквивалентную массу металла и определить металл. 43. Эквивалентная масса четырехвалентного элемента равна 3г. Какого процентное содержание кислорода в его оксиде? 44. Вычислить эквивалентную массу серы в соединении, содержащем 5,92% водорода. 45. Вычислить валентность хрома в оксиде с 68,42%-м содержанием хрома. 46. Плотность газа равна 1,34 г/л. Какова его относительная плотность по воздуху? 47. Найти молекулярную формулу углеводорода (соединение водорода с углеродом), содержащего по массе 93.75 углерода, если плотность этого вещества по воздуху равна 4,41. 48. При разложении карбоната кальция выделилось 11,2 л углекислого газа (н.у). Сколько граммов едкого калия (гидроксида калия) потребуется для связывания этго количества газа? 49. Вычислить массу азота в 1 кг: а) калийной селитры KNO3; б) аммиачной селитры NH4NO3. В какой из них больше процентное содержание азота? 50. Сколько граммов металла с эквивалентной массой 12,16 г/моль взаимодействует с 310 см3 кислорода при н.у?
Тема 3 СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКИЙ ЗАКОН 51. Какая из приведенных электронных формул атома соответствует элементу натрию: а)1s22s22p63s2 б)1s22s22p63s23p1 в)1s22s22p63s1 52. Какие элементы в приведенных парах являются электронными аналогами: Ti – V, Ti – Zn, Ti – Ge? Ответ обосновать, составить электронные формулы атомов этих элементов . 53. Какая электронная формула соответствует наиболее активному металлу: а)1s22s2 б) 1s22s22p63s23p64s1 в)1s22s22p63s23p63d104s1 54. Структура валентного электронного слоя атома выражается формулой …3d54s2 . Назовите этот элемент и охарактеризуйте его свойства. 55. Почему элемент кислород стоит в VI группе периодической системы, имея валентность 2? 56. К какому семейству относится элемент с порядковым номером 31? Ответ подтвердить электронной формулой элемента. 57. В какой группе и подгруппе находится элемент, атом которого на 3d – орбитали имеет 3 электрона? Его электронная структура. 58. Почему хлор и марганец находятся в одной группе, но в разных подгруппах? Охарактеризовать их свойства. 59. Какая из приведенных частиц имеет электронную конфигурацию, одинаковую с атомом Аргона: Са2+, К+, Cl, K? 60. Обосновать место нахождения элемента ванадия (V) в V группе периодической системы с точки зрения электронной структуры его атома? 61. Назвать элемент и написать его электронную формулу, если валентные электроны его атома имеют следующие значения квантовых чисел: n=4, l=0, m=0, ms= +1/2 62. Какие значения квантовых чисел имеют валентные электроны атома элемента алюминия? 63. Указать элемент, валентные электроны которого имеют конфигурацию …4s24 p2. Охарактеризовать валентные электроны квантовыми числами. 64. Квантовые числа для электронов внешнего энергетического уровня атомов элемента имеют следующие значения: n=4, l=0, m=0, ms=+1/2. Составить электронную формулу атомов этого элемента и определить, сколько свободных 3d- орбиталей он содержит. 65. Какие значения принимают квантовые числа валентных электронов атомов магния Mg? 66.У какого элемента 4-го периода – хрома или селена - сильнее выражены металлические свойства? Ответ мотивировать строением атомов элемента. 67. Чем можно объяснить переменную валентность атома хрома? Составить электронную конфигурацию и электронно-графическую формулу атома. 68. На примерах любых элементов покажите периодическое изменение изменение их свойств и обоснование его с точки зрение строения их атомов. Ответ обосновать строение атомов этих элементов.
Тема 4 ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ При решении задач этого раздела пользуйтесь табл. 3 приложения. 71. При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод CS2 (г). Написать термохимическое уравнение этой реакции, вычислить ее тепловой эффект. Ответ: +65,43 кДж 72. Написать термохимическое уравнение реакции между СО (г) и водородом, в результате которой образуются СН4 (г) и Н2О (г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия? Ответ: 618,48 кДж. 73. Вычислить теплоту образования NO, исходя из термохимического уравнения 4NH3 (г) + 5О2 (г) = 4NO (г) + 6Н2О (ж); ΔН0 х.р. = -1168,80 кДж. Написать термохимическое уравнение реакции образования NO. Ответ: 90,37 кДж. 74. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Написать термохимическое уравнение этой реакции, вычислить ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ: -78,97 кДж. 75. Исходя из теплоты образования воды (ж) и теплового эффекта реакции: Н2О2 (ж) = Н2О (ж) + 1/2 О2 (г); ΔН х.р. = -97,9 кДж, вычислить теплоту образования Н2О2. Ответ: -187,4 кДж. 76. Сколько теплоты выделится при сжигании 38 г сероуглерода, если теплота образования его +115,28 кДж/моль. Ответ: -551,3 кДж. 77. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составить термохимическое уравнение этой реакции и вычислить теплоту образования С6Н6 (ж). Ответ: +49,03 кДж. 78. Вычислить, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж. 79. Вычислить тепловой эффект реакции восстановления оксида цинка углем с образованием СО, если ΔН0ZnO = -348 кДж/моль. Ответ: 237,5 кДж. 80. Вычислить тепловой эффект реакции образования 120 г оксида магния: 2Mg (к) + СО2 (г) = 2MgO (к) + С (к). Ответ: -1215,225 кДж. 81. Исходя из реакции SiO2 (к) + 2MgO (к) + Si (к); ΔН0 х.р. = -372 кДж. Вычислите теплоту образования оксида кремния (IV). Ответ: -831,66 кДж. 82. При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж. 83. При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Написать термохимическое уравнение это реакции с образованием паров воды и оксида углерода (IV). Вычислить теплоту образования С2Н5ОН (ж). Ответ: -277,67 кДж/моль. 84. Вычислить теплоту образования оксида железа (III) в реакции Fe2O2 (к) + 2Al (к) = 2Fe (к) + Al2O3 (к); ΔН0 х.р. = -852 кДж. Ответ: - 46,19 кДж/моль. 85. Вычислить теплоту образования NН3 (г), исходя из уравнения реакции горения аммиака, если тепловой эффект реакции равен -15303 кДж. Ответ: -46,19 кДж/моль. 86. При взаимодействии 12,6 г железа с серой выделилось 22,62 кДж теплоты. Вычислить теплоту образования сульфида железа FeS. Ответ: -100,46 кДж/моль. 87. При сгорании 1,7 л ацетилена (н.у.) выделяется 58,7 кДж теплоты. Написать термохимическое уравнение реакции и вычислить теплоту образования С2Н2 (г). Ответ: 226,75 кДж/моль. 88. Сера сгорает в окиси азота (I) согласно уравнению: 2N2O (г) + S (к) = 2N2 (г) +SO2 (г). Вычислить тепловой эффект сгорания 5 г серы в оксиде азота (I). Ответ: -71,9 кДж. 89. Вычислить тепловой эффект реакции: B2O3 (к) +3Mg (к) = 2В (к) +3MgO (к), если в реакции участвует 7 г оксида бора. Ответ: -53,95 кДж. 90. Написать уравнение реакции горения метана и вычислить, сколько теплоты выделится при сгорании 10 кг метана. Ответ: -50 ∙ 104 кДж. 91. Вычислить тепловой эффект реакции восстановления оксида хрома (III) алюминием. Написать термохимическое уравнение реакции. 92. При сгорании 3,6 г магния выделяется 90,37 кДж тепла. Вычислить теплоту образования оксида магния. Ответ: -601,45 кДж. 93. Исходя из теплоты образования воды (ж) и теплового эффекта реакции: Н2О2 (ж) = Н2О + 1/2 O2 (г); ΔН0 х.р. = -97,9 кДж, вычислить теплоту образования перекиси водорода. 94. Вычислить тепловой эффект реакции образования 10 кг чистого карбида кальция СаС2: СаО (к) + 3С (к) = СаС2 (к) + СО (г). Ответ: 72171,875 кДж. 95. Вычислить тепловой эффект реакции горения 11,2 л газообразного аммиака с образованием газообразного азота и воды в парообразном состоянии. Ответ: -316, 57 кДж.
Тема 5 НАПРАВЛЕННОСТЬ ХИМИЧЕСКИХ ПРОЦЕССОВ При решении задач этого раздела пользуйтесь табл.3 приложения. 96. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислить ΔG0298 реакции, протекающей по уравнению: 4NH3 (г) + 5О2 (г) = 4NO (г) + 6Н2О (г). Возможна ли эта реакция при стандартных условиях? Ответ: -957,77 кДж. 97. Вычислить изменение энтропии в реакциях: а) С2Н4 (г) + 3О2 (г) = 2СО2 (г) + 2Н2О (г); б) СН4 (г) + 4Сl (г) = ССl4 (ж) + 4НСl (г). Ответ: -29,8 кДж; -117 Дж 98. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислить ΔG0298 реакции, протекающей по уравнению: СО (г) + 3Н2 (г) = СН4 (г) + Н2О (г). Возможна ли эта реакция при стандартных условиях? Ответ: -142,16 кДж 99. Прямая или обратная реакция будет протекать при с.у в системе: 2NO(г) + + O2(г) = 2NO2(г)? Ответ дайте по значению ∆G реакции. Ответ: 69,71 кДж. 100. По данным таблицы вычислить ∆С° реакции и определить принципиальную возможность ее осуществления при стандартных условиях: Ответ: -505,5 кДж. 101. При каком значении температуры наступит равновесие системы: 4HCI (г) + O2 (г) = 2Н2O (г) + 2Сl2 (г); ∆H = -114,42 кДж? Ответ: 891 К. 102. Вычислить изменение энтропии для реакций, протекающих по уравнениям: а) 2СН4 (г) = С2Н2 (г) + ЗН2 (г); 6) N2 (г) + ЗН2 (г) = 2NH3 (г); в) С (графит) + О2 (г) = С02 (г). Почсму в этих реакциях ∆S298 > 0; < 0;~0? Ответ: 220.21 Дж/К; -198,26 Дж/К; 2.93 Дж/К. 103. По табличным данным вычислить ∆G° реакции н определить принципиальную возможность ее осуществления при стандартных условиях: S02 (г) + 2H2S (г) = 2S (к) + 2H2O (ж). Ответ: -108,2 кДж. 104. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислить ∆G298 реакции, протекающей по уравнению: СO2 (г)+ 4H2 (г) = CH4 (г) + 2H2O (ж). Возможна ли эта реакция при стандартных условиях? Ответ: -130,89 кДж. 105. По данным таблицы вычислить ∆С° реакции и определить принципиальную возможность ее осуществления при стандартных условиях. HCI (г) + 1/2O2 (г) = Сl2(г) + H2O (ж). Ответ: -120.6 кДж. 106. Вычислить ∆C° реакции и определить, в каком направлении она может протекать при стандартных условиях: N2 (г) + 1/2O2 (г) = N2O (г). 107. Возможна ли при стандартных условиях экзотермическая реакция H2 (r) + CO2 (г) = CO (г) + H2O (ж) ∆H = -2.85 кДж? Зная тепловой эффект реакции абсолютные стандартные энтропии соответствующих веществ определите ∆G этой реакции. Ответ: +19,91 кДж. 108. Восстановление Fe3O4 оксидом углерода идет по уравнению: Fe3O4(к) + СO(r) = 3FeO(к) + CO2(г). Вычислить ∆G и сделать вывод о возможности само произвольного протекания этой реакции при с.у. Чему равно ∆S в этом процессе? 109. Возможно ли в с.у. реакция восстановления оксида CuO водородом? 110. По данным таблицы вычислить ∆G0 реакции и определить принципиальную возможность ее осуществления при стандартных условиях: 2HF(г) + 1/2O2(г) = F2(г) + H2O(ж) Ответ: 302,5 кДж. 111. Вычислить ∆H, ∆S и ∆G298 реакции, протекающей по уравнению TiO2(к) + 2C(к) = Ti (к) + 2СО (г). Возможна ли реакция восстановления TiO2 углеродом при температуре 1000К? Ответ: 722,86 кДж; 364,84 Дж/К; 358,02 кДж; +684,14 кДж. 112. На основании стандартных тсплот образования и абсолютных стандартных энтропии соответствующих веществ вычислить ∆G0298 реакции, протекающей по уравнению: С2H4(г) + 3O2(r) = 2СO2(г) + 2Н2O(ж). Возможна ли эта реакция при стандартных условиях? Ответ: - 1331,21 кДж. 113. Уменьшается или увеличивается энтропия при переходах: а) воды в пар; б) графита в алмаз? Почему? Вычислить ∆S° для каждого превращена. Сделать вывод о количественном изменении энтропии при фазовых и аллотропических превращениях. Ответ: 1)118,78 Дж/ (моль К); б) -3,25 Дж/ (моль-К). 114. Вычислить, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению: PCl5(г) = РСl3() + Сl2 (г); ∆H = 92,59 кДж. Oтвет: 351 К. 115. Осуществима ли принципиально реакция восстановления водородом в стандартных условиях оксида МnО. ∆G0MnO = -403. 116. При каком значении температуры наступит равновесие в системе СО(г) + 2Н2(г) = CH3OH(ж); ∆H = -128,05 кДж. Ответ: -385,5 К. 117. Осуществима ли в стандартных условиях реакция восстановления водородом оксида свинца РbО. 118. Вычислить ∆H, ∆S и ∆G298 реакции, протекающей по уравнению Fe2O3(K) + ЗН2(г) = 2Fe(к) + 3H2O(г). Возможна ли реакция восстановления Fe2O3 водородом при 500 К? Ответ: -95,81кДж; 138,83 Дж/К; 54,6кДж; 25,8 кДж. 119. По данным таблицы вычислить ∆G° реакции и определить принципиальную возможность се осуществления при стандартных условиях: N2O(г) + NO(г) = NO2(г) + N2(г) Ответ:385,5 кДж. 120. Реакция горения ацетилена идет по уравнению С2Н2(г) + 5/2О2(г) = 2СО2(г) + H2O(ж). Вычислить ∆S298 и ∆G298 . объяснить уменьшение энтропии в результате этой реакции. Ответ: -1235,15 кДж; -216.15 Дж/(моль∙К).
Тема 6 ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ 121. При 393 К реакция заканчивается за 18 мин. Через сколько времени эта реакция при 453 К, если температурный коэффициент скорости реакции равен 3? 122. В гомогенной газовой системе A + B ↔ C + D равновесие установилось при концентрациях: [B] = 0,05 моль/л и [C] = 0,02 моль/л. Константа равновесия системы 0,04. Вычислите исходные концентрации вещества А и В. Ответ: [A] = 0,22 моль/л, [B] = 0,07 моль/л 123. Написать выражение константы равновесия для гетерогенной системы CO2(r) + C ↔ 2CO(r). Как изменится скорость прямой реакции образования СО, если его концентрацию уменьшить в 4 раза? Как следует изменить давление для повышения выхода СО? 124. В какую сторону сместится равновесие в следующих обратимых реакциях: а) N2(r) + O2(r) ↔ 2NO(r), ∆H = -179,74 кДж; б) СО(r) + H2O(r) ↔ CO2(r) + H2(r), ∆Н = 41,8 кДж при повышении температуры? При повышении давления? При повышении концентрации исходных веществ? 125. Температурный коэффициент скорости некоторых ферментативных процессов равен 7. Принимая скорость ферментативного процесса при 20 ̊С за единицу, указать, чему могла бы быть равна скорость этого процесса при 50 ̊С. Ответ: 343. 126. Равновесие гомогенной системы 4HCl(p) + O2(r) ↔ 2H2O(p) + 2Cl2(p) установилось при следующих концентрациях реагирующих веществ: [H2O] = 0,14 моль/л; [Cl2] = 0,14 моль/л; [HCl] = 0,2 моль/л; [O2] = 0,32 моль/л. Вычислить исходные концентрации хлористого водорода и кислорода. Ответ: [HCl] = 0,48 моль/л, [O2] = 0,39 моль/л. 127. Вычислить константу равновесия для гомогенной системы CO(г) + H2O(r) ↔ CO2(r) + H2(r), если равновесные концентрации веществ равны: [CO] = 0,004 моль/л, [H2O] = 0,064 моль/л, [CO2] = 0,016 моль/л, [H2] = 0,016 моль/л. Чему равны исходные концентрации воды и оксида углерода (II)? Ответ: k = 1, [H2O] = 0,08 моль/л, [CO] = 0,02 моль/л. 128. На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент скорости равен 2,7. 129. Во сколько раз следует увеличить концентрацию оксида углерода (II) в системе 2СО(г) = СО2(г) + С(к), чтобы скорость реакции увеличилась в 4 раза? Ответ: в 2 раза. 130. Реакция между оксидом азота (II) и хлором протекает по уравнению 2NO(r) + Cl2(r) ↔ 2NOCl(r). Как изменится скорость при увеличении: а) концентрации оксида азота в 2 раза; б) концентрации хлора в 2 раза; в) концентрации обоих веществ в 2 раза? Ответ: а) в 4 раза, б) в 2 раза, в) в 8 раз. 131. При повышении температуры на 50 ̊С скорость реакции возросла в 1200 раз. Вычислить γ реакции. Ответ: 4,12. 132. Написать уравнение скорости реакции С(к) + O2(г) = СО2(г) и определить, во сколько раз увеличится скорость реакции при повышении концентрации кислорода в 3 раза. Ответ: в 3 раза. 133. Во сколько раз следует увеличить давление, чтобы скорость образования NO2(r) по реакции 2NO(r) + O2(r) ↔ 2NO2(r) возросла в 1000 раз? Ответ: в 10 раза. 134. Исходные концентрации оксида углерода (II) и паров воды равны и составляют 0,03 моль/л. Вычислить равновесные концентрации СО, Н2О и Н2 в системе СО(г) + Н2О(г) ↔ СО2(г) + Н2(г), если равновесная концентрация СО2 оказалась равной 0,01 моль/л. Вычислить константу равновесия. Ответ: 0,02 моль/л, 0,02 моль/л, 0,01 моль/л 135. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции возросла в 30 раз (γ = 2,5)? Ответ: на 37 ̊С. 136. Во сколько раз следует увеличить концентрацию водорода в системе N2(r) + 3H2(r) ↔ 2NH3(r), чтобы скорость реакции возросла в 100 раз? Ответ: в 4,64 раза. 137. При некоторой температуре равновесные концентрации в системе 2SO2(r) + O2(r) ↔ 2SO3(r) составляли [SO2] = 0,04 моль/л, [O2] = 0,06 моль/л, [SO3] = 0,02 моль/л. Вычислить константу равновесия и исходные концентрации оксида серы (IV) и кислорода. Ответ: 4,17; 0,06 моль/л; 0,07моль/л. 138. В какую сторону сместится равновесие обратимых реакций: а) 2NO(r) + O2(r) = 2NO2(r), ∆H0298 < 0; б) N2(r) + O2(r) = 2NO(r), ∆H0298 > 0 при повышении температуры? При понижении температуры? При уменьшении объема системы? 139. Вычислить константу равновесия системы COCl2(r) ↔ CO(r) + Cl2(r), если при некоторой температуре концентрации оксида углерода и хлора в системе равны и составляют 0,001 моль/л, а [COCl2] = 4,65·10-5 моль/л. Ответ: К = 2,1·10-2. 140. Определите температурный коэффициент скорости реакции, если при понижении температуры на 45°С реакция замедлилась в 25 раз. 141. В какую сторону сместится равновесие в следующих обратимых реакциях: а) PCl5(r) = PCl3(r) + Cl2(r) – 129,58 кДж, б) N2(r) + 3H2(r) ↔ 2NH3(r) + 91,96 кДж. При повышении температуры? При понижении давления? При уменьшении концентрации исходных веществ? 142. Скорость некоторой реакции при 100°С равна единице. Чему будет равна скорость этой реакции при 200°С, если принять температурный коэффициент скорости реакции равным 3? 143. Как надо поступить, чтобы при данной концентрации исходных веществ максимально повысить выход SO3 по реакции 2SO2(r) + O2(r) = 2SO3(r) + 188,1 кДж? 144. Напишите выражение для константы равновесия гетерогенной системы С(к) + Н2О(г) = СО(г) + Н2(г). Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров? 145. Константа скорости реакции 2А + В = С равна 0,8. Начальные концентрации [A] = 2,5 моль/л, [B] = 1,5 моль/л. В результате реакции концентрация вещества В стала 0,5 моль/л. Вычислить, чему стала равна концентрация вещества А и скорость реакции. Ответ: 0,5 моль/л, 0,1 моль/л·с. | |