| Общая информация » Каталог студенческих работ » ЕСТЕСТВЕННЫЕ ДИСЦИПЛИНЫ » Химия |
| 23.11.2017, 12:46 | |
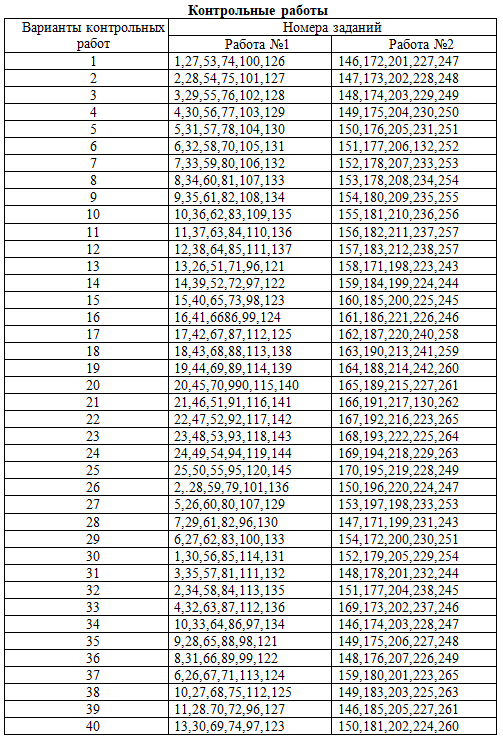
Тема 7 ХИМИЧЕСКИЕ СИСТЕМЫ При решении заданий этого раздела см, табл. 4 приложения. 146. Напишите молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) NaClO и Н2SO4; б) К2SiO3 и HNO3; в) BaCl2 и Na2SO4 . 147. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) КСN и Н2SO4 ; б) FeSO4 и (NH4)2S ; в)Ca(OH)2 и HCl. 148. Напишите молекулярные уравнения реакций, которые выражаются следующими краткими ионными уравнениями: a) HSO3- + OH- = H2O + SO32- ; б) Be(OH)2 + 2OH- = BeO22-+2H2O; в) Al(OH)3 + 3H+ = Al3+ + 3H2O. 149. Напишите молекулярные и ионно-молекулярные уравнения реакции взаимодействия в растворах между: а) РЬ(NO3)2 и KI; б) АlСl3, и Аl(OH)3; в) НВг и Са(ОН)2. 150. Напишите молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Сг2(SO4)3 и КОН; б) NaHS и Н2SO4; в) Sn(OH)2 и НС1. 151. Какие из веществ: NaCl , CuSO4 , CH3COOK Mg(ОН)2 — взаимодействуют с раствором серной кислоты? Написать молекулярные и ионно-молекулярные уравнения этих реакций. 152. Напишите молекулярные и ионно-молекулярные уравнения реакций взаимодействия и растворах между: а) РЬ(NO3)2и К2SO4; б)Cu(NO3)2 и K2S; в) NiSO4 и NaOH. 153. Напишите молекулярные уравнения реакций, которые выражаются краткими ионно-молекулярными уравнениями: а)СаСО3 + 2Н+ = Са2+ + H2O + СО2 б) Сг(OH)3 + OH- = CrO2- + 2H2O; в) Cu2+ + H2S = CuS + 2H+ 154. Напишите молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Ва(ОН)2 и Na2SO4; б) Сu(ОН)2 и H2SO4; в) СаСО3 и НNО3. 155. Напишите молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Na3PO4 и СаС12; б) К2СО3, и ВаС12; в)Zn(ОН)2 и КОН. 156. Написать молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а)Fe(OH)3 + 3H+ = Fe3+ + 3H2O ; б)Cd2+ + 2OH- = Cd(OH)2; в)H+ + NO2- = HNO2. 157. Напишите молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а)РЬS и НС1; б)А1(ОН)3, и NaOH; в) КОН и СоCl2. 158. Какие из веществ: Аl(OН)3 ; H2SO4 ; Ва(ОН)2 — будут взаимодействовать с гидроксилом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. 159. Напишите молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Н2SO4 и Na2СО3 ; б) ВаС12 и K2SO4; в) СН3СООNa и НС1. 160. Напишите молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) FeС13, и АgNO3 ; б) СuSO4 и (NH4)2S ; в) МgСО3 и НС1. 161. Напишите молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) СО32- + 2H+ = CO2 + H2O ; б) СН3СОО- + H+ = СН3СООН; в) Fe3+ + 3OH- = Fe(OH)3. 162. Какие из веществ: КСl, NiSO4, Ва(ОН)2, NaHCO3 взаимодействуют с раствором гидроксида натрия. Напишите молекулярные и ионно-молекулярные уравнения этих реакций. 163. Напишите молекулярные и ионные уравнения реакций, протекающих между веществами: а) МgСО3, и HN03); б) CH3COOH и NaOH; в) Ва(OH)2 и HСl. 164. Напишите молекулярные и ионно-молекулярные уравнения реакции взаимодействия в растворах между: а) РЬ(NO3)2 и КI; б) А1Сl3 и АgNО3); в) НВг и Са(ОН)2. 165. Напишите молекулярные уравнения реакций, которые выражаются следующими краткими ионными уравнениями: a) Cu2++S2- = CuS; б) Pb(ОН)2+2OH- = PbO22- + 2H2O; в)SiO32- + 2H+ = H2SiO3. 166. Напишите молекулярные и ионные уравнения реакций, протекающих между веществами: а) Pb(ОН)2 и HN03; б) Hg(NО3)2 и КI; в) CdSO4 и Na2S. 167. Напишите молекулярные и ионные уравнения реакций, протекающих между веществами: а) K2SiO3 и НС1; б) КНСО3 и КОН; в) Ba(NО3)2 и Na2SO4. 168. Напишите молекулярные уравнения реакций, которые выражаются следующими краткими ионно-молекулярными уравнениями: а) Zn2+ + H2S = ZnS + 2H+; б) НСО3- + Н+ =H2O + СО2; в) Н+ + ОН- = H2O. 169. К каждому из веществ: Сг(ОН)3 , Bа(ОН)2 , HNO3 , FeCl3 прибавили раствор едкого кали. В каких случаях произошли реакции? Выразите их молекулярными и ионными уравнениями. 170. Напишите молекулярные и ионно-молекулярные уравнения реакций взаимодействия и растворах между: а) СиSO4 и Н2S; б) Al(ОН)3 , и КОН; в) FeCl3 и NaОН.
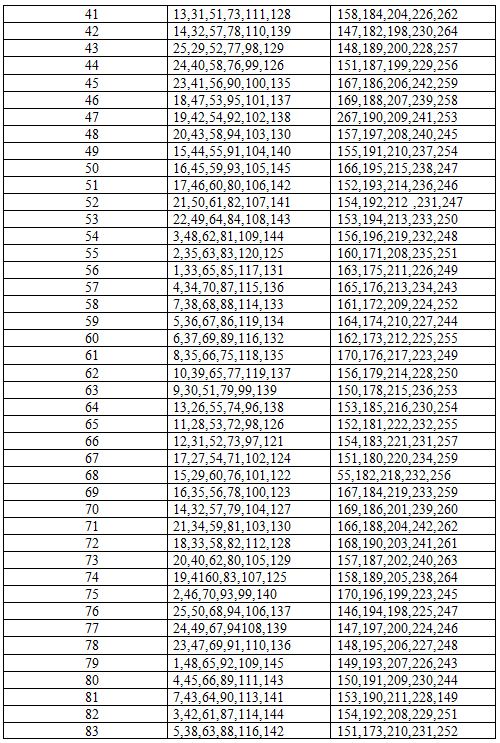
Тема 8 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Для всех приведенных ниже схем окислительно-восстановительных реакций составьте электронные уравнения, расставьте коэффициенты, и укажите, какое вещество является окислителем, какое – восстановителем, что окисляется и что восстанавливается. 171. FeSO4 + Br2 + H2SO4 → Fe2(SO4)3 + HBr KMnO4 + HBr → Br2 + KBr + MnBr2 + H2O 172. Hg + HNO3 → Hg(NO3)2 + NO2 + H2O H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + MnSO4 + K2SO4 + H2O 173. KMnO4 + H3PO3 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O H2S + Cl2 + H2O → H2SO4 + HCl 174. KClO3 + MnO2 + KOH → K2MnO4 + KCl + H2O HNO3 + Ca → NH4NO3 + Ca(NO3)2 + H2O 175. SnCl2 + HgCl2 + HCl → Hg + H2[SnCl6] K2S + KMnO4 + H2SO4 → S + K2SO4 + MnSO4 + H2O 176. Al + HNO3 = Al(NO3)3 + NH4NO3 + H2O FeSO4 + KClO3 + H2SO4 → Fe2(SO4)3 + KCl + H2O 177. KIO3 + KI + H2SO4 → I2 + K2SO4 + H2O KClO3 + Na2SO3 → KCl + Na2SO4 178. K2SO3 + K2Cr2O7 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O P + HClO3 + H2O → H3PO4 + HCl 179. H2S + HNO3 → S + NO2 + H2O Mg + H2SO4 → MgSO4 + H2S + H2O 180. NaBr + MnO2 + H2SO4 → MnSO4 + Na2SO4 + Br2 + H2O Cu2O + NHO3 → Cu(NO3)2 + NO + H2O 181. HI + K2Cr2O7 + H2SO4 → I2 + K2SO4 + Cr2(SO4)3 + H2O H2SO3 + HClO3 → H2SO4 + HCl 182. KNO2 + KMnO4 + H2O → KNO3 + MnO2 + KOH Au + HNO3 + HCl → AuCl3 + NO + H2O В задачах 183 – 197 укажите, какой коэффициент стоит перед восстановителем. 183. FeS + HNO3 → Fe(NO3)3 + H2SO4 + NO2 + H2O KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O 184. HCl + KMnO4 → Cl2 + MnCl2 + KCl + H2O K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O 185. CrCl3 + Br2 + KOH → K2CrO4 + KBr + KCl + H2O FeS + HNO3 → Fe(NO3)2 + S + NO + H2O 186. P + KMnO4 + H2O → KH2PO4 + K2HPO4 + MnO2 NaCrO2 + PbO2 + NaOH → Na2CrO4 + Na2PbO2 + H2O 187. Mn(NO3)2 + NaBiO3 + HNO3 → HMnO4 + Bi(NO3)3 + NaNO3 + H2O I2 + Cl2 + H2O → HIO3 + HCl 188. PbS + HNO3 → PbSO4 + NO2 + H2O Cd + KMnO4 + H2SO4 → CdSO4 + 4MnSO4 + K2SO4 + H2O 189. Mg + H2SO4 → MgSO4 + H2S + H2O FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O 190. Na2SO3 + KMnO4 + H2SO4 → Na2SO4 + MnSO4 + K2SO4 + H2O Cr2O2 + KClO3 + KOH → K2CrO4 + KCl + H2O 191. KI + KMnO4 + H2SO4 → I2 + MnSO4 + H2O NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O 192. NaNO2 + KMnO4 + H2SO4 → NaNO3 + K2SO4 + MnSO4 + H2O K2Cr2O7 + HCl → Cl2 + CrCl3 + KCl + H2O 193. KI + NaNO2 + H2SO4 → I2 + NaNO3 + K2SO4 + H2O MnSO4 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + PbSO4 + H2O 194. FeSO4 + KMnO4 + H2SO4 → Fe(SO4)3 + MnSO4 + K2SO4 + H2O HCl + CrO3 → Cl2 + CrCl3 + H2O 195. CuCl2 + KI → CuCl + I2 + KCl FeSO4 + NaClO + NaOH + H2O → Fe(OH)3 + Cl2 + Na2SO4 196. K2CrO4 + FeSO4 + H2SO4 → Fe(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O AsH3 + HNO3 → H3AsO4 + NO2 + H2O 197. KBr + KBrO3 + H2SO4 → Br2 + K2SO4 + H2O KClO3 → KClO4 + KCl
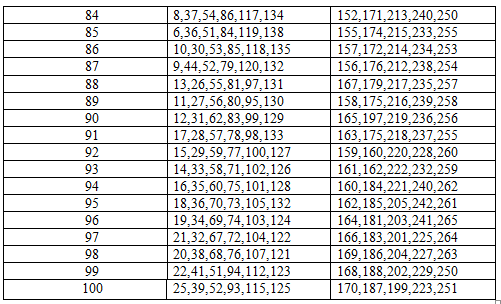
Тема 9 СВОЙСТВА МЕТАЛЛОВ При решении задач этого раздела см. табл 5 приложения 198. Алюминий вытесняет водород из воды только при добавлении щелочи. Ответ обосновать соответствующими уравнениями реакций. 199. Кусочек латуни (сплав цинка и меди) растворили в азотной кислоте. В раствор добавили избыток щелочи. В растворе или в осадке находятся цинк и медь? Составить уравнения реакций. 200. Кусочек серебряной монеты массой 0,3 г растворили в азотной кислоте и осадили серебро из полученного раствора в виде хлорида серебра. Масса осадка составляла 0,199 г. Сколько процентов серебра (по массе) содержалось в монете? 201. При погружении железной пластинки массой 20,4 г в раствор медного купороса масса её увеличилась и составила 22 г. Какая масса железа при этом растворилась? 202. В присутствии влаги и углекислого газа медь окисляется и покрывается зеленым налетом. Какое образуется соединение? Составить уравнение реакции. Что произойдет, если на него подействовать соляной кислотой? 203. Гидроксид какого из s- элементов II периода проявляет амфотерные свойства? Составить уравнения реакций, доказывающих такой характер гидроксида. 204. Серебро не растворяется в разбавленной серной кислоте, но хорошо растворяется в концентрированной. Почему? Составить молекулярное уравнение реакции. 205. Какую кислоту – разбавленную или концентрированную азотную – экономичнее (расход кислоты меньше) взять для растворения меди. Составить уравнения реакций растворения меди. 206. При восстановлении водородом смеси оксида железа (II) и оксида железа (III) получили железо массой 122 г. Определить массовую долю, % каждого оксида в смеси. 207. Металлическая ртуть содержит примеси «неблагоприятных» металлов – цинка, олова, свинца. Для их удаления ртуть обрабатывают раствором нитрата ртути (II). На чем основан такой метод очистки? Составить уравнения реакций. 208. Что называется царской водкой? Написать уравнение реакции взаимодействия её с платиной, которая окисляется до соединения (IV). 209. В каких из приведенных растворов масса кадмиевой пластинки увеличивается: а) нитрата серебра; б) сульфата цинка; в) хлорида никеля (II). Ответ обосновать соответствующими реакциями. 210. В какой металлической таре можно хранить раствор медного купороса: а) оцинкованной; б) луженой (покрытой оловом); В) никелированной; г) медной. Ответ обосновать. 211. Медные предметы после погружения в раствор хлорида ртути (II) становится как бы «серебряными». Почему? Составить уравнение протекающей реакции. 212. Технический цинк массой 1,32 г обработали серной кислотой. Объём выделившегося при этом водорода при нормальных условиях составлял 448 мл. Определить содержание % цинка в технических металле. 213. Цинковую пластинку массой 80 г погрузили в раствор нитрата свинца (II). Через некоторое время масса пластинки стала больше и составила 94 г. Почему? Ответ обосновать соответствующими реакциями. Какая масса свинца садилась на пластинке? 214. Деталь цинка массой 73 г поместили в раствор сульфата никеля (II). Через некоторое время масса образует сталь 71,8 г. Почему? Сколько растворилось цинка? 215. В раствор сульфат меди поместили порошок магния массой 20 г. Через некоторое время металлический осадок собрали и высушили. Его масса увеличилась и составила 28 г. Сколько меди при этом выделилось из раствора? 216. Определить массу технического алюминия с содержанием 98,4% чистого алюминия, который потребуется для алюмотермического получения хрома из оксида хрома (III). 217. Образец сплава железа с углеродом (чугун) массой 7,27 г растворили в серной кислоте. Объём выделившегося водорода при нормальных условиях составлял 2,8 л. Определить содержание, % углерода в этом сплаве. 218. Образец сплава цинка и меди (латуни) массой 20 г обработали избытком «концентрированного раствора щелочи. При этом выделился газ объёмом 5,2 л (при нормальных условиях). Определить содержание, % цинка и меди в сплаве. 219. При растворении некоторого металла «Х» в азотной кислоте выделился оксид азота (II). Полученный раствор нейтрализовали избытком раствора щелочи. При этом образовался осадок голубого цвета, который после прокаливания приобрел темную окраску. Какой это металл? Составить уравнения соответствующих реакций. 220. Образец оксида железа массой 32 г восстановлен до свободного металла оксидом углерода (II). Определить формулу оксида железа, если объем газа, вступившего в реакцию, составил при нормальных условиях 13,44л. 221. Один из сплавов меди – бронза, содержит 85% меди, 12% олова и 3% цинка. Какой объем оксида азота (IV) при нормальных условиях выделится при действии концентрированной азотной кислоты на образец массой 30г. 222. Металл ванадий получают восстановлением оксида ванадия (V) металлическим кальцием. Какую массу металла можно получить при восстановлении концентрата массой 400г, в котором массовая доля оксида ванадия составляет 85%?
Тема 10 ЭЛЕКТРОХИМИЧЕСКИЕ СИСТЕМЫ При решении задач этого раздела см. табл. 5 приложения. 223. Медь не вытесняет водород из разбавленных кислот. Почему? Но если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начнется бурное выделение водорода. Дать объяснение, составив уравнения электронные анодного и катодного процессов. 224. Как происходит амфотерная коррозия луженного железа при нарушении покрытия? Составить электронные уравнения анодного и катодного процессов. 225. Железное изделие покрыли никелем. Какое это покрытие – анодное или катодное? Составить уравнения анодного и катодного процессов коррозии изделия при нарушении целостности покрытия в кисло среде. 226. В раствор соляной кислоты поместили цинковую пластинку, покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивировать соответствующими электронными уравнениями. 227. Как протекает амфотерная коррозия железа, покрытого никелем, если покрытие нарушено? Составить уравнения анодного и катодного процессов. К какому типу покрытий – анодному или катодному оно относится? 228. Цинковую и железную пластину опустили в раствор сульфата меди. Какие процессы протекают на каждой пластинке? Изменится ли что-нибудь, если наружные концы их соединить проводником? Ответ обосновать уравнениями окислительно-восстановительных реакций. 229. В чем сущность протекторной защиты металлов? Какой металл целесообразней выбрать для защиты от коррозии свинцовой оболочки кабеля: Zn, Mg, Cr? Составить уравнения анодного и катодного процессов амфотерной коррозии. Какое вещество является продуктом коррозии? 230. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрей образуется ржавчина? Составить уравнения анодного и катодного процессов. 231. Неочищенная медь содержит примеси серебра и цинка. Что произойдет с этими примесями при электролитическом рафинировании меди? Составить схему электродных процессов при электролизе. 232. Если опустить в разбавленный раствор H2SO4 пластинку из чистого железа, то выделение на ней пузырьков водорода идет медленно и постепенно прекращается. Но если к ней прикоснуться цинковой палочкой, начнется бурное выделение водорода. Какой металл при этом растворяется? Составить уравнение электронных процессов. 233. Водный раствор содержит ионы Fe2+, Ag+, Bi3+, Mg2+, Pb2+ одинаковой концентрации. В какой последовательности эти ионы будут восстанавливаться на катоде при электролизе? Какой из этих металлов нельзя получить таким способом? 234. Химические процессы, происходящие при работе железно-никелевого аккумулятора, выражаются схемой: Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2? Составить уравнения реакций окисления и восстановления. Рассчитать, сколько граммов железа вступает в реакцию, если при этом образуется 0,5 моля Ni(OH)2? 235. Какие заклепки следует ставить на железном изделии, чтобы процесс коррозии и изделия и заклепок протекал равномерно? Составить уравнение окислительно-восстановительных процессов в нейтральной среде. 236. Составить гальванический элемент, в основе работы которого лежит суммарное уравнение электродных процессов: Cu + Ag- = Cu2+ + Ag0. Составить уравнения анодного и катодного процессов. 237. Цинковая и серебряная пластинки соединены внешним проводником и опущены в раствор серной кислоты. Составить уравнение окислительно-восстановительных реакций, протекающих на электродах. 238. Медная и платиновая пластинки соединены внешним проводником и опущены в раствор нитрата серебра. Какие процессы протекают на электродах? Составить уравнения реакций. 239. Как объяснить явление, наблюдаемое рудокопами, добывающими медные руды: их железные кирки обмеднялись с поверхности при прикосновении с рудничными водами. Составить уравнения соответствующих реакций. 240. О каком металле II группы периодической системы элементов идет речь, если при помещении раствора его соли на медную пластинку на ней появляется серебрист белое пятно. Объяснить это с химической точки зрения уравнением реакции. 241. Алюминий склепан с медью. Какой металл будет подвергаться коррозии, если эти металлы попадут в кислую среду. Составить уравнение окислительно-восстановительных процессов. 242. Железо покрыто хромом. Какой из металлов будет корродировать в случае нарушения поверхностного слоя покрытия в атмосфере промышленного района (влажный воздух содержит CO2, SO3 и другие газы)? Составить уравнения окслительно-восстановительных процессов.
Тема 11 ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. ПОЛИМЕРЫ 243. Какая общая формула выражает состав этиленовых углеводородов (алкенов)? Какие химические реакции наиболее характерны для них? Что такое полимеризация, поликонденсация? Чем отличаются друг от друга эти реакции? 244. Каковы различия в составах предельных и непредельных углеводородов? Составьте схему образования каучука из дивинила и стирола. Что такое вулканизация? 245. Какие соединения называют альдегидами? Что такое формалин? Составьте схему получения фенолоформальдегидной смолы и рассчитайте её массу, если израсходовано по 500 молей исходных полимеров. 246. Напишите уравнение реакции получения ацетилена. При взаимодействии какого вещества с ацетиленом образуется акрилонитрил? Составьте схему полимеризации акрилонитрила. 247. Как получают в промышленности стирол? Приведите схему его полимеризации. Определите массу стирола, которую нужно взять для получения 1т полистирола, если потери в производстве составляют 15%. 248. Какая общая формула выражает состав ацетиленовых углеводородов (алкинов)? Как из метана получить ацетилен, затем винилацетилен, а из последнего хлоропрен? 249. Написать уравнение реакции дегидратации пропилового спирта. Составить схему полимеризации полученного углеводорода. Чему равен массовый выход продукта реакции дегидратации, если из 30 кг спирта получено 19кг углеводорода? 250. Как называют углеводороды, представителем которых является изопрен? Составить схему сополимеризации изопрена и изобутилена. Какая масса образовавшегося полимера, если его выход составляет 70% и израсходовано по 350 молей мономеров? 251. Написать структурную формулу акриловой кислоты и уравнение реакции взаимодействия этой кислоты с метиловым спиртом. Определить массу образовавшегося продукта, если в реакцию вступило 3,4кг метилового спирта. Составить схему полимеризации образовавшегося продукта реакции. 252. Как из карбида кальция и воды по реакции Кучерова получить уксусный альдегид, а затем винил уксусную кислоту (винил ацетат)? Написать уравнения соответствующих реакций. Составить схему полимеризации винилацетата. 253. Напишите уравнение реакции поликонденсации этиленгликоля. Назовите полимер, получающийся при этой реакции. 254. Написать уравнение реакции полимеризации формальдегида и определить коэффициент полимеризации получения полиформальдегида со средней молекулярной массой 45000. 255. Полимером какого непредельного углеводорода является натуральный каучук? Написать структурную формулу этого углеводорода. Что такое вулканизация каучука? В чем различие строения и свойств каучука и резины? 256. Какие углеводороды называются алкенами? Приведите пример. Какова общая формула этих углеводородов? Составить схему получения полиэтилена. 257. Написать структурную формулу метакриловой кислоты и уравнение реакции ее с метиловым спиртом, назвать продукт реакции. Составить схему полимеризации бутадиена (дивинила). 258. Какие углеводороды называют алкадиенами? Приведите пример. Какова общая формула этих углеводородов? Составить схему полимеризации и определить массу полученного полимера, если в реакцию вступило 250 молей мономера. 259. Какие соединения называют полимерами? Назвать два типа реакции, в результате которых можно получить полимеры и привести пример каждого типа. Назвать в них исходные мономеры и полученные полимеры. 260. Изопреновый каучук получают полимеризацией изопрена. Составить уравнение реакции. 261. Для получения синтетического волокна «нитрон» в качестве мономера используют акрилонитртл СН2=СH-СN. Составить уравнение полимеризации этого мономера. 262. Определить коэффициент полимеризации изобутилена при получении полиизобутилена с М=56280. Составить уравнение реакции. 263. Как из карбида кальция, хлорида натрия, серной кислоты и воды получить винилхлорид? Написать уравнение соответствующих реакций. Составить схему полимеризации винилхлорида. 264. Написать уравнение реакции полимеризации формальдегида. Какое количество полимера образуется, если для реакции было взято 250г раствора формальдегида с массовой долей 40%. 265. Муравьиный альдегид вступает в реакцию полимеризации с мочевиной (карбамидом) CO(NH2)2 образует синтетическую карбамидную смолу. Составить уравнение реакции, считая, что на 1 моль карбамида необходим 2 моль формальдегида.
| |