| Общая информация » Каталог студенческих работ » ЕСТЕСТВЕННЫЕ ДИСЦИПЛИНЫ » Химия |
| 13.11.2025, 18:01 | |
ТАБЛИЦА ЗАДАНИЙ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ
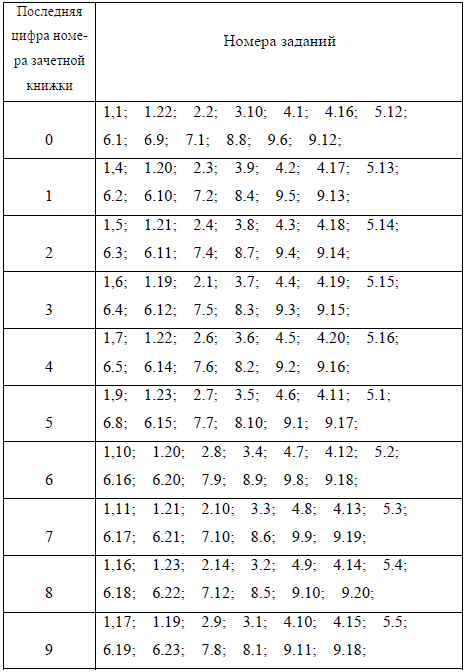
ЗАДАНИЯ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ Раздел 1. Важнейшие химические понятия и законы 1.1 Основные этапы развития атомно-молекулярного учения в химии. Дайте определение основным понятиям: атом, молекула, относительная атомная и относительная молекулярная масса, моль, молярная масса. 1.2. Закон сохранения массы веществ М.В. Ломоносова, его значение в химии. Взаимосвязь между массой и энергией по А.Эйнштейну. 1.3. Закон постоянства состава. Дальтониды. Бертоллиды. Приведите примеры. 1.4. Дайте определение эквивалента простого вещества; эквивалента сложного вещества. Рассчитайте молярные массы эквивалентов следующих веществ: алюминий; гидроксид кальция; ортофосфорная кислота, сульфат хрома (III). 1.5. Закон Авогадро. Следствие из закона Авогадро. Какой объем при нормальных условиях занимают: а) кислород массой 4 грамма: аммиак массой 51 грамм ? 1.6. Число Авогадро. Сколько молекул содержится в 3 мл водорода при нормальных условиях? Сколько ионов натрия содержится в 10 граммах гидроксида натрия? 1.7. Число Авогадро. В каком количестве (моль) вещества сульфата калия содержится: а) 3,01х1023 атомов кислорода; б) 3,01х1023 атомов калия; в) 16 граммов серы? 1.8. Дайте определение эквивалента простого вещества; сложного вещества. Рассчитайте молярные массы эквивалентов следующих веществ: гидроксид железа (III); серная кислота; барий; нитрат алюминия. 1.9. Фосфор образует два различных по составу хлорида: PCl3 и PCl5. Эквивалент какого элемента сохраняется в этих соединениях постоянным: фосфора или хлора? Ответ обоснуйте. 1.10. Выберите правильные значения эквивалентных объемов кислорода и водорода при нормальных условиях: а) 11,2 л О2 и 22,4 л Н2 ; б) 11,2 л О2 и 11,2 л Н2 ; в) 5,6 л О2 и 11,2 л Н2. Ответ обоснуйте. 1.11. Одинакова ли молярная масса эквивалента железа в соединениях FeSO4 и Fe2(SO4)3? Ответ обоснуйте расчетами. Рассчитайте молярные массы эквивалента следующих соединений: оксид углерода (IV); угольная кислота; карбонат хрома(III); гидроксид хрома(III). 1.12. Рассчитайте молярные массы эквивалента следующих соединений: ортофосфорная кислота; ортофосфат бария; оксид фосфора(V), гидроксид бария. 1.13. Определить молярные массы эквивалентов металла и серы, если 3,24 г металла образуют 3,48 г оксида и 3,72 г сульфида. 1.14. Вычислить молярную массу эквивалента элемента, оксид которого содержит 22,2% кислорода. 1.15. Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34 г металла окисляются 0,680 л кислорода (н.у.). 1.16. Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определить молярную массу эквивалента металла и объем выделившегося водорода (н.у.). 1.17. Какой объем кислорода (н.у.) потребуется для реакции с 15 г элемента, молярная масса эквивалента которого равна 3 г/моль-экв? 1.18. Вычислить массовую долю металла в его оксиде, если молярная масса эквивалента металла равна 56,2 г/моль-экв. 1.19. При нормальных условиях 1 г воздуха занимает объем 773 мл. Какой объем займет та же масса воздуха при 00С и давлении, равном 93,3 кПа (700 мм рт. ст.)? 1.20. Давление газа в закрытом сосуде при 120С равно 100 кПа (750 мм рт. ст.). Каким станет давление газа, если нагреть сосуд до 300С? 1.21. При 70С давление газа в закрытом сосуде равно 96,0 кПа. Каким станет давление, если охладить сосуд до -330С? 1.22. При давлении 98,7 кПа и температуре 910С некоторое количество газа занимает объем 680 мл. Найти объем газа при нормальных условиях. 1.23. Какие условия называют нормальными? Рассчитайте, сколько литров кислорода, измеренного при нормальных условиях, образуется при разложении 2 моль бертолетовой соли KClO3 с образованием KCl и О2? Раздел 2. Строение атома. Периодическая система химических элементов Д.И. Менделеева 1.1. Охарактеризуйте состав атома (количество протонов, нейтронов, электронов) и напишите полные электронные формулы атомов следующих элементов: углерод; хлор; мышьяк; молибден; свинец. Укажите номер внешнего электронного слоя для каждого из указанных атомов элементов, число электронов во внешнем слое. 1.2. Взаимосвязь между строением атома и структурой Периодической системы химических элементов Д.И.Менделеева. На что указывают: а) порядковый номер элемента; б) номер периода, в котором находится элемент? Чем определяется число элементов в том или ином периоде? Элементы каких семейств (s-, p-, d-, fэлементы) начинают и какие завершают любой период? 1.3. Какие элементы (исходя из классификации s-, p-, d-, fэлементы) образуют главные и какие – побочные подгруппы? В чем принципиальная разница в заполнении внешнего и предвнешнего электронных слоев между элементами главных и побочных подгрупп? Как это сказывается на свойствах элементов? 1.4. Что такое относительная электроотрицательность атомов элементов? Как изменяется эта характеристика по периодам и по группам у элементов главных подгрупп? Расположите элементы в порядке убывания относительной электроотрицательности: фосфор, хлор, кислород, мышьяк, натрий, магний. 1.5. Охарактеризуйте состав атома (количество протонов, нейтронов, электронов) и напишите полные электронные формулы следующих элементов: кислород, фосфор, титан, сурьма, висмут. Укажите номер внешнего электронного слоя для каждого из указанных элементов, число электронов во внешнем слое. 1.6. Что является основой для разделения элементов на металлы и неметаллы? Охарактеризуйте положение металлов в периодической системе элементов Д.И.Менделеева. Какие металлы являются наиболее активными? Почему? 1.7. Что называется окислителем? Как изменяются окислительные свойства в периодах и группах у атомов элементов главных подгрупп? Атомы каких элементов проявляют наиболее выраженные окислительные свойства? 1.8. Что называется восстановителем? Как изменяются восстановительные свойства в периодах и группах у атомов элементов главных подгрупп? Атомы каких элементов проявляют наиболее выраженные восстановительные свойства свойства? 1.9. Какие важнейшие частицы входят в состав ядра атома? Укажите их характеристики (заряд, масса). Что такое изотопы? Какие изотопы называются радиоактивными? Почему у элементов конца периодической системы (начиная с какого элемента?) все изотопы радиоактивные? Применение изотопов в биологии. 1.10. Охарактеризуйте по положению в периодической системе элементы главной подгруппы VII группы периодической системы на примере хлора (электронное строение, возможные степени окисления, водородные и кислородные соединения, их свойства). В чем заключаются и чем объясняются особенности свойств фтора? 1.11. Охарактеризуйте по положению в периодической системе элементы главной подгруппы VI группы периодической системы на примере серы (электронное строение, возможные степени окисления, водородные и кислородные соединения, их свойства). В чем заключаются и чем объясняются особенности свойств кислорода? 1.12. Охарактеризуйте по положению в периодической системе элементы главной подгруппы V группы периодической системы на примере фосфора (электронное строение, возможные степени окисления, водородные и кислородные соединения, их свойства). В чем заключаются и чем объясняются особенности свойств азота? 1.13. Охарактеризуйте по положению в периодической системе элементы главной подгруппы VI группы периодической системы на примере углерода (электронное строение, возможные степени окисления, водородные и кислородные соединения, их свойства). В чем заключаются и чем объясняются особенности и многообразие свойств соединений углерода? 1.14. Что такое относительная электроотрицательность атомов элементов? Как изменяется эта характеристика у атомов элементов главных и побочных подгрупп? Расположите элементы в порядке убывания относительной электроотрицательности: кальций, бром, фтор, фосфор, калий. 1.15. Охарактеризуйте состав атома (количество протонов, нейтронов, электронов) и напишите полные электронные формулы следующих элементов: азот; ванадий; селен; йод; висмут. Укажите номер внешнего электронного слоя для каждого из указанных элементов, число электронов во внешнем слое. Раздел 3. Основы термодинамики химических процессов 3.1. Рассчитайте количество вещества кислорода, необходимое для получения 1000 кДж теплоты по реакции в стандартных условиях: 2NO (г) + O2(г) = 2NO2 (г), с учетом, что DН0обр(NO(г)) = 90,3 кДж/моль; DН0обр(NO2 (г)) = 33,5 кДж/моль. 3.2. Водяной газ представляет собой смесь равных объемов водорода и оксида углерода(II). Рассчитайте количество теплоты, выделяющейся при сжигании 112 л водяного газа, взятого при нормальных условиях. 3.3. Зависит ли тепловой эффект реакции от присутствия в системе катализаторов? Ответ обоснуйте. 3.4. Объясните, почему процессы растворения веществ в воде могут самопроизвольно протекать как с эндотермическим, так и с экзотермическим эффектом? 3.5. Вычислить значение DН0298 для протекающих в организме реакций окисления глюкозы: а) С6Н12О6 (к) = 2С2Н5ОН (ж) + 2СО2 (г) б) С6Н12О6 (к) = 6О2 (г) + 6СО2 (г) + 6Н2О (ж), с учетом, что DН0обр(С6Н12О6 (к)) = 1273 кДж/моль; DН0обр(С2Н5ОН (ж)) = -277,6 кДж/моль; DН0обр(СО2 (г)) = -393,5 кДж/моль; DН0обр(Н2О (ж)) = -285,8 кДж/моль. Какая из этих реакций поставляет организму больше энергии? 3.6. На качественном уровне (не производя вычислений) обоснуйте знак DS0 следующих процессов: а) 2СО2 (к) = 2СО2 (г) б) 2NH3 (г) = N2 (г) + 3H2(г) в) 2NO (г) + О2 (г) = 2NO2 (г) 3.7. Почему при низких температурах критерием, определяющим направление самопроизвольного протекания реакции, может служить знак DН0, а при высоких температурах таким критерием является знак DS0? 3.8. Обоснуйте, каков знак DG процесса таяния льда при температуре 263 К: а) DG < 0; б) DG = 0; в) DG > 0. 3.9. Сожжены с образованием Н2О(г) равные объемы водорода и ацетилена, взятые при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз? DН0обр(СО2 (г)) = -393,5 кДж/моль; DН0обр(Н2О (г)) = -241,8 кДж/моль. DН0обр(С2Н2 (г)) = 226,8 кДж/моль; 3.10. Какие из перечисленных оксидов могут быть восстановлены алюминием при 298 К: CuO, FeO, CaO, Cr2O3, SnO2. Ответ подтвердите расчетами. 3.11. Какие из следующих термодинамических функций относятся к функциям состояния системы: теплота, энтальпия, энтропия, работа расширения газа, свободная энергия Гиббса? 3.12. При образовании 1 моля газообразного HF из простых веществ выделилось 270,7 кДж теплоты. Чему равна стандартная энтальпия образования фтороводорода? 3.13. Вычислить изменение стандартной энтальпии следующих реакций: а) C2H6(г) + 3,5 O2(г) = 2CO2(г) + 3H2O(ж) б) C2H5OH(ж) + 3O2(г) + 2CO2(г) + 3H2O(ж) 3.14. В смеси, состоящей из 22,4 л фтора и 44,8 л водорода, произошла реакция. Определить изменение стандартной энтальпии реакции. 3.15. Указать знак изменения энтропии в процессах: а) сгорание водорода; б) разложение воды на водород и кислород; и знак изменения энтропии в следующих реакциях: а) NH3(г) + HCl(г) = NH4Cl(тв) б) COCl2(г) = CO(г) + Cl2(г) в) PCl3(г) + Cl2(г) = PCl5(г) г) N2(г) + 3H2(г) = 2NH3(г) 3.16. Для какого состояния систем справедливо соотношение ΔH = Т⋅ΔS? Для каких реакций это соотношение невыполнимо ни при каких условиях? 3.17. Возможно ли при стандартных условиях (298 К) самопроизвольное протекание реакции Н2(г) + Cl2(г)= 2HCl(г), если ΔНр-ции = − 185 кДж/моль и ΔSр-ции= 20 Дж/(моль⋅К). 3.18. Вычислить величину изменения стандартной энергии Гиббса и определить возможность самопроизвольного протекания реакции Fe2O3(тв) + H2(г) = 2Fe(тв) + 3Н2О(г) при температурах 300 К и 800 К. 3.19. Сформулировать условия самопроизвольного протекания реакций, сопровождающихся: а) увеличением энтропии и энтальпии; б) уменьшением энтальпии и энтропии; в) увеличением энтропии и уменьшением энтальпии; г) уменьшением энтропии и увеличением энтальпии Раздел 4. Скорость химической реакции. Химическое равновесие 4.1. Как зависит скорость химической реакции от концентраций реагирующих веществ? Рассчитайте, во сколько раз увеличится скорость реакции взаимодействие серной кислоты с гидроксидом натрия при увеличении концентраций обоих реагирующих веществ в 2 раза. 4.2. Окисление аммиака идёт по уравнению: 2NH3 (Г) + 2О2(Г) = N2O(Г) + 3H2O(Г) Записать математическое выражение зависимости скорости этой реакции от концентраций реагирующих веществ. Рассчитать, как изменится скорость данной реакции при уменьшении концентрации кислорода в 5 раз. 4.3. Как изменится скорость реакции 2NO(г)+ O2 (г)→2 NO2 (г), если а) увеличить давление в системе в 2 раза, б) уменьшить объем системы в 2 раза, в) повысить концентрацию NO в 2 раза, г) повысить концентрацию О2 в 2 раза? 4.4. Как зависит скорость химической реакции от температуры? Как изменится скорость некоторой химической реакции при увеличении температуры от 40°С до 70°С, если температурный коэффициент реакции γ имеет значение: а) γ = 2; б) γ = 3; в) γ = 4. 4.5. При увеличении температуры на 800 скорость реакции возросла в 256 раз. Рассчитать температурный коэффициент скорости данной химической реакции. 4.6. Какие из вышеперечисленных реакций гомогенные, какие – гетерогенные? а) 2СО(г) + О2 (г)→ 2СО2(г) б) СН4 (г) + 2О2 (г) ® СО2 (г) + 2Н2О(г) в) СаСО3(тв) → СаО(тв) + СО2(г) г) С(тв.) + СО2(г) → 2СО(г) Написать уравнения, характеризующие зависимость скорости данных химических реакций от концентраций реагирующих веществ. 4.7. Константа скорости реакции А + 2В ® АВ2 равна 2 × 10 -3 л/моль×сек; определить скорость реакции в начальный момент, если концентрация вещества А, равная концентрации вещества В, составляет 0,4 моль/л; определить скорость через некоторое время τ , если к этому времени образовалось 0,1 моль/л АВ2. 4.8. Кинетическое уравнение химической реакции имеет вид ʋ = k · CА· CВ. Как изменится скорость реакции при увеличении концентраций веществ А и В в 2 раза? Изменится ли при этом константа скорости реакции? 4.9. Что называется скоростью химической реакции? Как зависит скорость реакции от температуры? Рассчитайте, чему равен температурный коэффициент реакции γ, если при увеличении температуры от 40оС до 60оС скорость реакции возросла в 6,25 раза. 4.10. Что такое энергия активации реагирующих веществ? Влияние катализаторов на величину энергии активации. Механизм протекания реакции в присутствии катализатора. Ферменты, их биологическая роль. 4.11. Как зависит скорость химической реакции от концентрации реагирующих веществ? Рассчитайте, во сколько раз увеличится скорость реакции взаимодействия ортофосфорной кислоты с гидроксидом калия (с образованием средней соли) при увеличении концентрации обоих реагирующих веществ в 3 раза. 4.12. Что называется химическим равновесием? Сформулируйте принцип Ле-Шателье. Объясните, в каком направлении сместится равновесие в системе 2СОгаз + О2газ ⮀ 2СО2газ ; DН0 < 0 а) при увеличении давления; б) при уменьшении температуры; в) при увеличении концентрации СО2. 4.13. Что называется химическим равновесием? Сформулируйте принцип Ле-Шателье. Объяснить, в каком направлении сместится равновесие в системе СО2газ + Ств ⮀ 2СОгаз; DН0 > 0 а) при увеличении давления? б) при уменьшении температуры? в) при увеличении концентрации СО2? 4.14. Что называется химическим равновесием? Сформулируйте принцип Ле-Шателье. Объяснить, в каком направлении сместится равновесие в системе 4HClгаз + О2газ ⮀ 2Сl2газ+ Н2О; DН0 < 0 а) при увеличении давления; б) при уменьшении температуры; в) при увеличении концентрации Сl2. 4.15. Что называется химическим равновесием? Сформулируйте принцип Ле-Шателье. Объяснить, в каком направлении сместится равновесие в системе 2SO2газ + O2газ ⮀ 2SO3газ ; DН0 < 0 а) при увеличении температуры; б) при уменьшении давления; в) при уменьшении концентрации SO2. 4.16. Что называется химическим равновесием? Сформулируйте принцип Ле-Шателье. Объяснить, в каком направлении сместится равновесие в системе СОгаз + Н2Огаз ⮀ CO2raз + H2raз ; DН0 < 0 а) при увеличении давления; б) при уменьшении температуры; в) при увеличении концентрации СО2. 4.17. Дать определение обратимой и необратимой реакции. Какие реакции являются необратимыми? 4.18. Что называется химическим равновесием? Почему оно называется динамическим? Какие концентрации реагирующих веществ называют равновесными? Выражение для константы равновесия. Приведите пример. 4.19. Что называют константой химического равновесия? Как зависит она от природы реагирующих веществ, их концентрации, температуры, давления? Каковы особенности математической записи для константы равновесия в гетерогенных системах? 4.20. Как повлияет увеличение давления на равновесие обратимой реакции Fe2O3 (к) + 3 СО(г) ⮀2 Fe(к)+ 3 СО2 ? Написать выражение для константы равновесия данной реакции. 4.21. Как повлияет повышение температуры на равновесие обратимой реакции СаCO3 (к) ⮀ CаO(к) + СО2 (г); ΔН° = 171,4 кДж. Ответ обоснуйте. Раздел 5. Растворы. Растворимость. Природа процессов растворения. Способы выражения состава растворов 5.1. Классификация дисперсных систем по признаку агрегатного состояния и исходя из размеров частиц дисперсной фазы. Дать определение грубодисперсных систем, коллоидных систем, истинных растворов. Привести примеры. 5.2. Какие системы называются коллоидными? В чем причина устойчивости коллоидных систем? Дать определение понятий: пептизация, коагуляция, седиментация. Факторы, способствующие коагуляции коллоидных систем. 5.3. Охарактеризовать строение мицеллы, образованной при взаимодействии хлорида бария с серной кислотой в присутствии избытка хлорида бария. Какой заряд приобретут коллоидные частицы? Как предотвратить пептизацию осадка? Какие ионы, входящие в состав сильного электролита, могут вызвать коагуляцию коллоидной системы? Как зависит коагулирующая способность ионов от их заряда? 5.4. Что называется раствором? Классификация растворов по агрегатному состоянию. Примеры. Критерии, по которым выделяется растворитель. Приведите примеры. 5.5. Растворимость. Зависимость растворимости от факторов: природы веществ, температуры, давления. 5.6. Тепловые эффекты при растворении. Природа процессов растворения. О чем свидетельствует выделение теплоты в процессе растворения? В каком случае процесс растворения сопровождается выделением энергии? 5.7. Растворимость. Классификация веществ по растворимости. Разбавленные растворы. Насыщенные растворы. Пересыщенные растворы. 5.8. Укажите стадии, на которые упрощенно можно разделить процесс растворения вещества в воде. Какая стадия для большинства солей является эндотермическим, а какая экзотермическим процессом? 5.9. Почему все кислоты и щелочи растворяются в воде с выделением тепла, а большинство солей – с поглощением? 5.10. Что выражает молярная концентрация раствора? Рассчитайте массу гидроксида натрия, необходимую для приготовления 300 мл 2М раствора этого вещества. Опишите процесс приготовления раствора. 5.11. Какой объем 5М раствора азотной кислоты нужно взять для приготовления 10%-ного раствора этого вещества (плотность 1,06 г/мл) объемом 600 мл? Опишите процесс приготовления раствора. 5.12. Что выражает нормальная (зквивалентная) концентрация раствора? Рассчитайте нормальную концентрацию раствора, полученного смешением Na2CO3 массой 10,6 г с водой объемом 300 мл (плотность воды 1,0 г/мл). Плотность полученного раствора принять равной 1,1 г/мл. 5.13. Какой объем 40%-ного раствора серной кислоты (плотность 1,25 г/мл) нужно взять для приготовления 100 мл 2М раствора этого вещества? 5.14. Какой объем 6М раствора серной кислоты нужно взять для приготовления 20%-ного раствора это вещества (плотность 1,12 г/мл) объемом 200 мл? Опишите процесс приготовления раствора. 5.15. Какой объем 60%-ного раствора ортофосфорной кислоты (плотность 1,42г/мл) нужно взять для приготовления 300 мл 2М раствора этого вещества. Опишите процесс приготовления раствора. 5.16. Какой объем 40%-ного раствора гидроксида натрия (плотность 1,43 г/мл) нужно взять для приготовления 400 мл 7М раствора этого вещества? Опишите процесс приготовления раствора. Раздел 6. Растворы. Теория электролитической диссоциации кислот, оснований и солей в водных растворах. Гидролиз солей 6.1. Что называется степенью электролитической диссоциации, ее значение для сильных электролитов, слабых и электролитов средней силы. Охарактеризуйте силу следующих электролитов: серная кислота; гидроксид алюминия; нитрат бария. Напишите процессы электролитической диссоциации этих соединений. 6.2. Степень электролитической диссоциации, ее зависимость от факторов: а) природы вещества; б) температуры; в) концентрации раствора. 6.3. Что называется электролитической диссоциацией? Укажите силу электролитов и напишите процессы электролитической диссоциации следующих соединений: сероводородная кислота; сульфат меди (II); гидроксид железа (III); сернистая кислота; гидроксид бария. 6.4. Что является движущей силой электролитической диссоциации? Как зависит способность электролитов к диссоциации от вида химической связи? Приведите примеры. 6.5. Указать, какие из перечисленных соединений являются электролитами и написать уравнения их электролитической диссоциации: НNO3, NaOH, FeCI3, C2H5OH, CH3COOH, C6H6, AI2(SO4)3, (CH3)2O, CH3COONH4, H3PO4. 6.6. Что такое константа диссоциации? Чем она отличается от степени диссоциации и от чего зависит? 6.7. Что называется произведением растворимости? Каковы условия образования и растворения осадков? 6.8. Составить ионные и молекулярные уравнения следующих реакций: а) CH3COOH + NaOH = … б) Zn(OH)2 + HNO3 = … в) CuSO4 + H2S = … г) BaCO3 + HCl = … 6.9. Написать в молекулярном и ионном виде уравнения процессов гидролиза соединений, образующихся в процессе взаимодействия : а) сульфата хрома (III) и карбоната натрия б) нитрата алюминия и сульфида калия. 6.10. Как влияет добавление растворов КОН, ZnCl2 , Na2S, соляной кислоты и твердого NaCl на гидролиз карбоната калия (гидролиз усиливается, ослабляется, влияния не наблюдается?). Ответ обоснуйте. 6.11. Как влияет добавление растворов NaОН, Na2CO3, Al2(SO4)3, серной кислоты и твердого К2SO4 на гидролиз хлорида цинка (гидролиз усиливается, ослабляется, влияния не наблюдается?). Ответ обоснуйте. 6.12. Написать в молекулярном и ионном виде уравнения трех стадий гидролиза хлорида железа (III). Объяснить, почему при комнатной температуре гидролиз идет только по первой стадии, а при кипячении раствора – по трем стадиям. 6.13. В одномолярном растворе нитрата цинка водородный показатель (рН) равен 2. Чему равна степень гидролиза соли ? 6.14. Что называется гидролизом? Какие соли подвергаются гидролизу? При гидролизе каких солей происходит изменение рН среды? Напишите уравнения (в ионной и молекулярной формах) процессов гидролиза следующих солей: сульфит алюминия; нитрат меди (II) (первая стадия); нитрит кальция. Охарактеризуйте среду. 6.15. Что такое водородный показатель среды (рН)? Интервалы значений рН для кислых, нейтральных и щелочных сред. Способы измерения рН. Значения рН важнейших природных растворов. Использование рН для изучения биологических процессов. 6.16. рН одного раствора равен 3, другого 6. Определить, в котором из растворов объемом 1 л концентрация [H+] больше и во сколько раз? 6.17. Вычислить [H+] в растворе, если рН = 6,2. 6.18. Вычислить рН 0,01N раствора уксусной кислоты. Степень диссоциации кислоты в растворе равна 0,042. 6.19. Определить рН раствора, в 1 л которого содержится 0,1 г гидроксида натрия. 6.20. Какие соли подвергаются гидролизу? Напишите уравнения ( в ионной и молекулярной формах) процессов гидролиза следующих солей: хлорид железа(III) (первая стадия); ортофосфат натрия (первая стадия); сульфид хрома (III). Охарактеризуйте среду. 6.21. Степень гидролиза. Зависимость степени гидролиза от факторов: а) природы вещества; б) температуры; в) концентрации соли в растворе. Напишите уравнения (в ионной и молекулярной формах) процессов гидролиза следующих солей: карбонат калия (первая стадия); нитрат цинка (первая стадия); карбонат железа (III). Охарактеризуйте среду. 6.22. Какие соли подвергаются гидролизу? При гидролизе каких солей происходит изменение рН среды? Напишите уравнения (в ионной и молекулярной формах) процессов гидролиза следующих солей: ортофосфат калия (I стадия); нитрат цинка (I стадия); карбонат железа (III). Охарактеризуйте среду. 6.23. В каком случае процесс гидролиза соли является необратимым? Напишите уравнения (в сокращенной ионной, ионномолекулярной и молекулярной формах) процессов гидролиза следующих солей: сульфит алюминия; нитрат меди (II) (первая стадия); нитрит кальция. Раздел 7. Окислительно-восстановительные реакции. Ряд стандартных электродных потенциалов. Сравнительная характеристика металлов. Взаимодействие кислот с металлами 7.1. Какие вещества называются восстановителями? Укажите простые и сложные вещества, являющиеся важнейшими восстановителями. Подберите стехиометрические коэффициенты (методом электронного баланса), укажите окислитель и восстановитель в реакции: Zn + K2Cr2O7 + H2SO4 → ZnSO4 + Cr2(SO4)3 + K2SO4 + H2O 7.2. Какие вещества называются окислителями? Укажите простые и сложные вещества, являющиеся важнейшими окислителями. Подберите стехиометрические коэффициенты (методом электронного баланса), укажите окислитель и восстановитель в реакции: K2S + KMnO4 + H2SO4 → S+ MnSO4 + K2SO4 + H2O 7.3. Типы окислительно-восстановительных реакций: межмолекулярные, внутримолекулярные, диспропорционирования. Приведите примеры. 7.4. Среди соединений: хлорид железа (II), хлорид железа (III), металлическое железо, сероводород, сульфит натрия, серная кислота – укажите восстановители, окислители и соединения с окислительно-восстановительной двойственностью. Ответ обоснуйте. 7.5. Обоснуйте, какой процесс окисление или восстановление происходит в превращениях веществ: a) 2FeSO4 ® Fe2(SO4)3 b) Fe2O3 ® 2Fe c) NH3 ® NO d) 2CI- ® CI2 e) CI- ® CIO-4 f) 2IO-4 ® I2 7.6. Используя ряд активности металлов, укажите, какие металлы взаимодействуют с водой: а) при обычных условиях, б) при нагревании, в) с перегретым паром, г) не взаимодействуют при любых условиях. Напишите соответствующие условия реакций. 7.7. Какие металлы могут взаимодействовать с водородом? Какие свойства, с точки зрения окислительно-восстановительных, проявляют при этом металл и водород? Почему образующиеся при этом гидриды обладают выраженными восстановительными свойствами? 7.8. Какие свойства, с точки зрения окислительно-восстановительных, проявляет любая кислота по отношению к металлу? В чем принципиальная разница между кислотами первой и второй группы? Какие из них обладают более выраженными окислительными свойствами? В чем это проявляется? 7.9. В чем особенность взаимодействия азотной кислоты с металлами? Допишите уравнение реакции Al + HNO3 paзб→…, подберите стехиометрические коэффициенты , укажите окислитель и восстановитель. 7.10. В чем особенность взаимодействия концентрированной серной кислоты с металлами? Допишите уравнение реакции Na + H2SO4 конц→…, подберите стехиометрические коэффициенты (методом электронного баланса), укажите окислитель и восстановитель. 7.11. Почему благородные металлы не окисляются индивидуальными концентрированными соляной и азотной кислотами, но окисляются смесью этих кислот, так называемой «царской водкой»? Ответ обоснуйте соответствующими уравнениями реакций. 7.12. В чем особенность взаимодействия азотной кислоты с металлами? Допишите уравнение реакции Са + HNO3 paзб →..., подберите стехиометрические коэффициенты (методом электронного баланса), укажите окислитель, восстановитель. Раздел 8. Основные классы неорганических соединений. Химические свойства оксидов, кислот, оснований, солей 8.1. Укажите, к какому типу относятся оксиды: оксид углерода (IV); оксид кальция; оксид алюминия. Напишите формулы соответствующих им гидроксидов, назовите полученные соединения. Напишите реакции, характеризующие химические свойства гидроксида алюминия. 8.2. Могут ли взаимодействовать между собой: а) кислота и кислотный оксид? б) кислотный оксид и основный оксид? в) два основных оксида? г) кислота и основание? д) кислота и соль? е) две соли? ж) кислотный оксид и соль? з) кислотный оксид и основание? Напишите уравнения возможных реакций; дайте необходимые пояснения в отношении условий и особенностей протекания процессов. 8.3. Напишите реакции, характеризующие химические свойства: ортофосфорной кислоты; гидроксида бария; оксида серы (VI); оксида цинка. 8.4. Какие пары веществ будут взаимодействовать между собой: оксид фосфора (V) и вода; оксид кальция и гидроксид натрия; оксид углерода (IV) и гидроксид бария; соляная кислота и железо; сульфат цинка и медь; нитрат серебра (1) и медь. Напишите уравнения соответствующих реакций. 8.5. В чем особенность свойств амфотерных оксидов и гидроксидов? Оксиды и гидроксиды каких элементов обладают амфотерными свойствами? Напишите реакции, характеризующие амфотерные свойства оксида цинка, гидроксида алюминия. Назовите полученные соединения. 8.6. С какими из нижеперечисленных веществ будет реагировать оксид фосфора (V): оксид углерода (IV); гидроксид калия; оксид магния; сульфат железа (III); вода; азотная кислота. Напишите уравнения соответствующих реакций. 8.7. Какие оксиды называются кислотными? Напишите формулы важнейших кислотных оксидов и соответствующих им кислот. Что образуется при взаимодействии кислотного оксида с веществом основного характера? Напишите следующие уравнения реакций: оксид азота(V) + гидроксид бария оксид фосфора (V) + оксид лития оксид кремния(IV) + гидроксид натрия. 8.8. Укажите, к какому типу относятся оксиды: оксид бария; оксид фосфора (V); оксид цинка. Напишите формулы соответствующих гидроксидов, назовите полученные соединения. Напишите реакции, характеризующие химические свойства гидроксида цинка. 8.9. Какие соли (кислые, средние, основные) могут быть образованы при взаимодействии гидроксида железа (III) и серной кислоты? Напишите уравнения соответствующих реакций. Назовите полученные соли. 8.10. Какие соли (кислые, средние, основные) могут быть образованы при взаимодействии ортофосфорной кислоты и гидроксида меди(II)? Напишите уравнения соответствующих реакций. Назовите полученные соли. Раздел 9. Химическая связь. Комплексные соединения 9.1. Что называется химической связью? От чего зависит тип связи между атомами в соединении? Укажите тип химической связи между атомами: водород и хлор; натрий и бром; алюминий и сера; кислород и кислород; железо и марганец. 9.2. Ковалентная химическая связь. Природа связи. Механизмы образования. Покажите на конкретных примерах образование ковалентных связей по обменному и донорноакцепторному механизмам. Как называются соединения, в которых присутствуют связи, образованные по донорноакцепторному механизму? 9.3. Какой тип связи способствует образованию немолекулярной структуры соединений? Каковы свойства соединений с немолекулярной структурой? Укажите тип химической связи и структуру (молекулярную, немолекулярную) соединений между атомами: сера и кислород; кальций и бром; фосфор и хлор; азот и азот; цинк и цинк. 9.4. Температуры кипения BF3, BCl3, BBr3 и BI3 соответственно равны 172, 286, 364, 483К. Объясните наблюдаемую закономерность. 9.5. Между атомами каких элементов возможно образование ионной связи? Исходя из природы ионной связи, объясните, почему соответствующие соединения имеют немолекулярную структуру, т.е. существуют в виде кристаллов. 9.6. Металлическая связь. Природа связи. Какие свойства металлов обусловлены особенностями металлической связи? Обоснуйте ответ. 9.7. Что называется химической связью? Между какими атомами образуется ковалентная химическая связь. Опишите типы (полярная. неполярная). Приведите примеры. Свойства соединений с ковалентным типом связи. 9.8. Водородная связь как важнейший вид межмолекулярного взаимодействия. Природа водородной связи, необходимое условие образования. Структуры веществ с водородной связью. Биологическая роль водородной связи.Примеры. 9.9. Что называется гибридизацией электронных орбиталей? Виды гибридизации. Приведите примеры. 9.10. sи pсвязи. Механизмы образования, прочность, поляризуемость. Приведите примеры. 9.11. Какие соединения называются комплексными? Укажите комплексную частицу, противоионы, комплексообразователь, его степень окисления, координационное число комплексообразователя, лиганды и назовите следующие комплексные соединения: Na3[А1(ОН)6], [Аg(NH3)2]Cl, K2[Cи(CN)4], К[АиСI4], [Cи(Н2О)4](ОН)2. 9.12. Какова природа связи в комплексных соединениях? Укажите комплексную частицу, противоионы, комплексообразователь, его степень окисления, координационное число, лиганды и назовите следующие комплексные соединения: [Al(H2O)6]Cl3, Ca[Cи(CN)4], H[AиCl4], K[Ag(SCN)2], [Ni(CO)4]. 9.13. Написать координационные формулы, исходя из того, что координационное число Со (III) равно 6, для следующих соединений: а) Co(NO2)3 . 6 NH3, б) Co(NO2)3 . 3 NH3 в) Co(NO2)3 . К NO2 . 2 NH3 г) Co(NO2)3 . 3 К NO2 9.14. Дать определение константы нестойкости комплексных ионов, привести выражение константы нестойкости для комплексного соединения [Zn(NH3)4] CI2. 9.15. Константы нестойкости комплексных ионов [Ag(CN)2]−, [Au(CN)2]− , [Cu(CN)2]− имеют значения, соответственно: 1.10- 21, 5.10- 39, 1.10- 16. Какой из этих ионов самый прочный? Написать уравнение диссоциации комплексных ионов и выражение для константы нестойкости этих комплексных ионов. 9.16. Определить заряд комплексных ионов и составить формулы комплексных соединений с приведенными ниже катионом или анионом: [Bi(3+)I4] [Co(3+)(Н2O)4CI2] [Cr(3+)(NH3)5CI] [Ni(2+)(CN)4], [Co(3+)(NH3)2 (NO2)4] [Pt(2+)(NH3)3 (NO2)] [Cu(2+)(NH3)4] [Cr(3+)(Н2O)4CI2] [Pt(4+)(NH3) CI3] 9.17. Комплексные кислоты, основания, соли, неэлектролиты. Укажите, к какому классу относится комплексное соединение и назовите его: Na[AиCl4], [Co[(NH3)6][Fe(CN)6], H[AиCl4], [Cи(Н2О)4](ОН)2, [PtBr4(NH3)2], [Cr(H2O)4Cl2], [Cи(H2O)6]SO4. 9.18. Назовите комплексные соединения: K3[Co(NO2)6], Cs[Ag(CN)2], Na3[AIF6], Na3[Ag(S2O3)2], [Zn(NH3)4](NO3)2, [Co(H2O)2(NH3)4]CI2 и напишите уравнения электролитической диссоциации этих соединений. 9.19. Типы комплексных соединений. Укажите комплексную частицу, противоионы, комплексообразователь, его степень окисления, координационное число комплексообразователя, лиганды и назовите следующие комплексные соединения: [Ni(NH3)6]Cl2, K[Аи(OH)4], K4[Fe(CN)6], [PtCl4(NH3)2], 9.20. Какова природа связи в комплексных соединениях? Укажите комплексную частицу, противоионы, комплексообразователь, его степень окисления, координационное число комплексообразователя, лиганды и назовите следующие комплексные соединения: [Си(NН3)4](ОН)2, К[Аи(ОН)4], [Сr(Н2О)4Сl2]Cl, Са[Си(CN)4]. | |