| Общая информация » Каталог студенческих работ » ЕСТЕСТВЕННЫЕ ДИСЦИПЛИНЫ » Химия |
| 03.11.2017, 21:41 | |
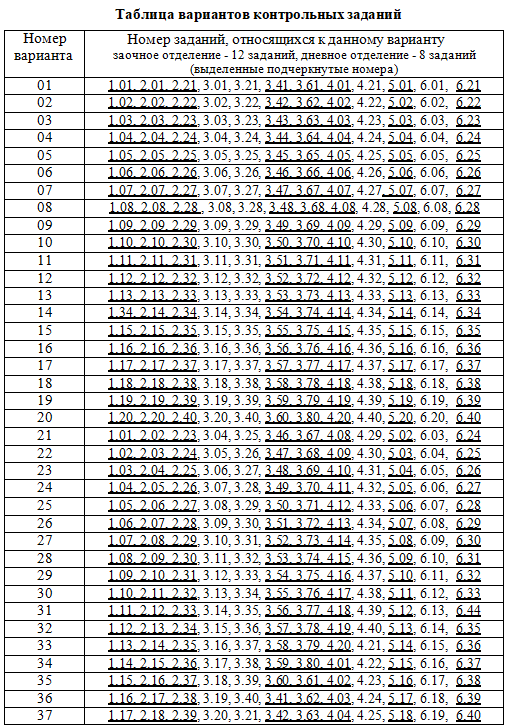
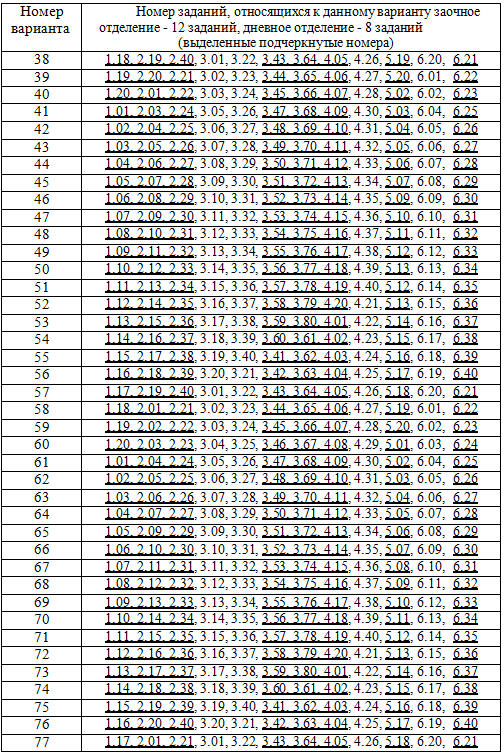
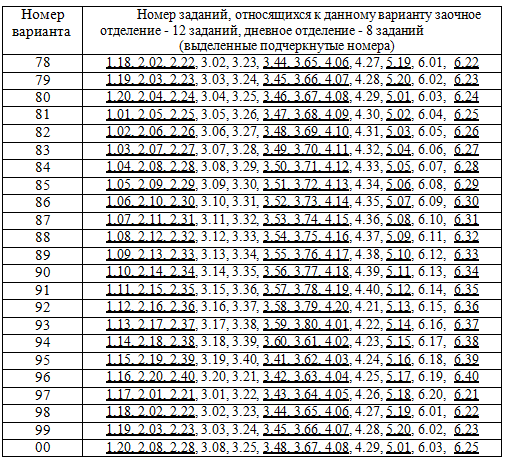
Каждый студент выполняет вариант контрольной работы, обозначенный двумя последними цифрами номера студенческого билета (шифра). Например, номер студенческого билета 54241, две последние цифры 41, им соответствует вариант контрольного задания 41. Количество заданий для студентов заочного отделения - 12 заданий, дневного отделения - 8 заданий (выделенные подчеркнутые номера в таблице вариантов). Таблица вариантов контрольных заданий приведена в конце пособия. Контрольная работа, выполненная не по своему варианту, преподавателем не рецензируется и не считается сданной. КОНТРОЛЬНЫЕ ЗАДАНИЯ 1 СОСТАВ, СТРУКТУРА И СВОЙСТВА МАТЕРИАЛОВ 1.01. Классификация и вещественный состав строительных материалов. 1.02. Свойства материалов (физические, механические, химические). 1.03. Эксплуатационные, изоляционные и конструктивные свойства материалов. 1.04. Технологические и декоративные свойства материалов. 1.05. Структура материалов. Атомно-молекулярная структура. Основные характеристики ионной, ковалентной, металлической, молекулярной химических связей. 1.06. Характеристика ионной химической связи на примере сульфата кальция (дигидрата CaSO4·2H2O и ангидрита CaSO4). Чем обусловлены возможности получения гипсовых вяжущих различных модификаций с различными свойствами? 1.07. Основные характеристики ковалентной химической связи. Силикаты, особенности их строения. Силоксановые связи. Строение поликремниевых кислот. Причины большого разнообразия кремнекислородных полимер- анионов. 1.08. Основные характеристики ковалентной химической связи. Донорно- акцепторный механизм образования ковалентной связи на примере кристаллогидратов – основных продуктов гидратации цементов. 1.09. Основные характеристики металлической химической связи. Механизм образования металлической связи на примере железа. Характерные кристаллические решетки (сингонии). 1.10. Молекулярная (Ван-дер-Ваальсова) химическая связь на примере органических вяжущих или полимеров. Внутримолекулярная водородная связь (примеры). 1.11. Структура материалов. Микроструктура. Классификация дисперсных систем. 1.12. Структура материалов. Дисперсные системы, типы структур по П.А. Ребиндеру (коагуляционные, конденсационно-кристаллизационные). 1.13. Структура материалов. Макроструктура (базальная, контактная и поровая структура). 1.14. Химические и физико-химические связи в твердых материалах. 1.15. Силы молекулярного взаимодействия (ориентационные, дисперсионные, электрические). 1.16. Конденсированное агрегатное состояние вещества. Фазовые р-Т – диаграммы на примере диаграммы состояния Н2О. 1.17. Твердые кристаллы. Строение кристаллических решеток (элементарная ячейка, узлы кристаллической решетки, сингония). 1.18. Классификация твердых кристаллов неорганических веществ. Полиморфизм. 1.19. Аморфное состояние вещества. Особенности строения и свойств аморфных веществ на примере стекол и аморфных полимеров. 1.20. Жидкие кристаллы. Особенности строения органических соединений образующих жидкие кристаллы. Анизотропия.
2 ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. ДИСПЕРСНЫЕ СИСТЕМЫ 2.01. Причины самопроизвольных поверхностных явлений. Примеры поверхностных явлений связанных с уменьшением величины межфазной поверхности. 2.02. Свободная поверхностная энергия и поверхностное натяжение. Факторы, влияющие на поверхностное натяжение. 2.03. Особенности адсорбции на границе раздела жидкость – газ. Адсорбционное уравнение Гиббса, его анализ и область использования. 2.04. Поверхностно-активные вещества, строение, классификация. Причины и механизм проявления их поверхностной активности. 2.05. Поверхностно-активные, поверхностно-инактивные вещества. Особенности строения. Влияние ПАВ и ПИАВ на поверхностное натяжение воды, графический вид изотерм. 2.06. Классификация ПАВ. Использование ПАВ в технологии строительства. 2.07. Моющее действие ПАВ. Явление солюбилизации, сущность, практическое значение. 2.08. Практическое применение ПАВ. Использование ПАВ в качестве стабилизаторов дисперсных систем. Механизм моющего действия растворов ПАВ. 2.09. Особенности адсорбции на границе твердое тело – газ. 2.10. Адсорбционные явления в коллоидных системах. Отличие физической адсорбции от хемосорбции? Типы связей между адсорбентом и адсорбтивом. 2.11. Поверхностные явления на границе твердое тело – жидкость. 2.12. Молекулярная адсорбция на твердой поверхности. Уравнения изотермы Лэнгмюра и Фрейндлиха. Их анализ и сфера применимости. 2.13. Адсорбция ионов на твердой поверхности. Понятие об ионитах. Обратимая ионообменная адсорбция – основа ионообменной хроматографии. 2.14. Ионообменная адсорбция, ее практическое применение. Катиониты и аниониты, их действие. 2.15. Гидрофильные и гидрофобные адсорбенты. Краевой угол смачивания. Адсорбция ПАВ из растворов на гидрофобных и гидрофильных адсорбентах. Влияние природы растворителя и адсорбента. 2.16. Характеристика и примеры гидрофильных и гидрофобных поверхностей. Как можно повлиять на смачивание поверхности? 2.17. Явление смачивания. Краевой угол смачивания. Роль ПАВ при смачивании поверхности. 2.18. Явления адгезии и смачивания. Параметры, используемые для их количественной характеристики. Влияние неоднородности и шероховатости твердых поверхностей на их смачивание и адгезию. 2.19. Взаимосвязь между адгезией и способностью жидкости смачивать твердую поверхность. Влияние природы твердого тела и жидкости (межмолекулярное взаимодействие в них) на смачивание и адгезию. В чем состоит различие между явлениями адгезии и смачивания? 2.20. Явления адгезии и когезии. Смачивание. 2.21. Классификация дисперсных систем по размерам дисперсных частиц, агрегатным состояниям дисперсной фазы и дисперсионной среды. Чем вызвана необходимость таких классификаций? 2.22. Методы получения дисперсных систем, их классификация и краткая характеристика. Какой метод получения дисперсных систем с термодинамической точки зрения наиболее выгоден? 2.23. Лиофильные и лиофобные дисперсные системы. Чем объясняется самопроизвольное возрастание межфазной поверхности при образовании лиофильных дисперсных систем? 2.24. Устойчивость дисперсных систем, характеристика различных видов устойчивости. 2.25. Причины возникновения структур в дисперсных системах. Условия формирования структур коагуляционного типа, их свойства, примеры. 2.26. Причины возникновения структур в дисперсных системах. Условия формирования структур конденсационно-кристаллизационного типа, их свойства, примеры. 2.27. Явление синерезиса и тиксотропии в дисперсных системах, механизм этих явлений. 2.28. Химический и минералогический состав грунтов. 2.29. Состав твердой фазы грунтов. 2.30. Состав жидкой фазы грунтов. 2.31. Состав газовой фазы грунтов. 2.32. Классификация грунтов. Химическое строение грунтов с точки зрения дисперсных систем. 2.33. Поглощение катионов грунтами. Ионный обмен. 2.34. Поглощение анионов грунтами. Хемосорбционные процессы. 2.35. Физическое поглощение грунтов. 2.36. Микрогетерогенные системы. Получение и стабилизация. Примеры этих систем, применяемых в строительстве. 2.37. Эмульсии, условия их образования, классификация и свойства. Примеры эмульсий, в том числе, применяемых в строительстве. 2.38. Суспензии, условия их образования, свойства. Пасты – концентрированные суспензии. Примеры суспензий, в том числе, применяемых в строительстве. 2.39. Пены, условия их образования и разрушения. Свойства пен. Примеры использования пен, в том числе в строительстве. 2.40. Порошки, состав, свойства. Агрегация и агломерация порошков, причины протекаемых поверхностных явлений.
3 ВЯЖУЩИЕ МАТЕРИАЛЫ 3.01. Отличие воздушных вяжущих от гидравлических. Зависимость свойств извести от состава сырья, процессы получения и твердения воздушной извести. 3.02. Влияние температуры обжига природного гипса на свойства получаемых вяжущих материалов. Дайте краткую сравнительную характеристику низкообжиговых и высокообжиговых гипсовых вяжущих. 3.03. Физико-химические основы процесса твердения вяжущих (на примере твердения строительного гипса). 3.04. Какие процессы происходят при получении и твердении высокопрочного и высокообжигового (эстрих-) гипса? Где применяют эти вяжущие? 3.05. Напишите уравнение процесса гашения воздушной, извести, продукты гашения в зависимости от количества взятой воды. Где применяются эти материалы? 3.06. Разновидности магнезиальных вяжущих. Процессы получения и особенности твердения этих вяжущих. 3.07. Строительный гипс и ангидритовый цемент. Получение этих видов вяжущих, твердение, применение. 3.08. Растворимое стекло как воздушное вяжущее. Процессы его получения и твердения. 3.09. Физические и химические процессы, протекающие при твердении воздушной извести. Какова роль песка, добавляемого в известковые растворы? 3.10. Кислотоупорный цемент, его состав и твердение. Роль песка и кремнефторида натрия в процессе твердения. 3.11. Получение силикатов натрия и калия, их применение в строительстве. Силикатный модуль и влияние его на вяжущие свойства жидкого стекла. 3.12. Энергетика процесса гашения воздушной извести. Правила техники безопасности при гашении извести. Известковое тесто: его состав, получение и карбонизация. 3.13. Известь негашеная (кипелка), известь гидратная (пушенка), известковое тесто. Их состав, получение, твердение. 3.14. Каковы различия в составе, процессах получения, твердения и применении ангидритового цемента и эстрих-гипса? 3.15. Какое соединение магния применяется в качестве вяжущего материала? Каковы особенности процесса твердения этого вяжущего? 3.16. Гидросиликатное твердение воздушной извести. Область применения продуктов автоклавного твердения известково-песчаных растворов. 3.17. Гидролиз силикатов калия и натрия в присутствии СO2 и без CO2. Применение этих процессов в строительстве. 3.18. Термическая диссоциация карбоната кальция. Влияние температуры и давления на равновесие этого процесса. Применение этого процесса в производстве строительных материалов. 3.19. Ступенчатая дегидратация двуводного гипса. Использование продуктов гидратации в строительстве. 3.20. Какие вяжущие материалы содержат полуводный гипс, а какие безводный гипс? Напишите реакции получения и твердения этих вяжущих. Как влияет состав гипсового вяжущего на скорость его твердения? 3.21. Понятие о гидравлических вяжущих. Гидравлическая известь. Сырье, производство, реакции твердения, применение. 3.22. Понятие о гидравлических вяжущих. Глиноземистый цемент. Сырье, получение, твердение, применение. 3.23. Портландцемент. Сырье и процессы, протекающие при обжиге сырьевой смеси. 3.24. Портландцемент. Минералогический состав клинкера. Взаимодействие минералов клинкера с водой. 3.25. Минералогический состав глиноземистого цемента. Процессы схватывания и твердения глиноземистого цемента. 3.26. Что называется портландцементным клинкером и как он получается. Укажите его химический и минералогический состав. 3.27. К какому типу вяжущих относится глиноземистый цемент? Где он применяется? Какие процессы лежат в основе схватывания и твердения глиноземистого цемента? 3.28. Сырье для получения портландцемента. Производство этого цемента. Какова роль добавок гипса при получении цемента? 3.29. В состав каких вяжущих материалов входят алюминаты кальция? Напишите уравнения реакций взаимодействия этих минералов с водой? 3.30. В состав каких вяжущих материалов входят силикаты кальция? Напишите уравнения реакций взаимодействия этих минералов с водой и дайте характеристику их активности. 3.31. Какие из минералов, входящих в состав портландцементного клинкера, характеризуются повышенной активностью по отношению к воде? Как это сказывается на прочности изделий из цемента? Каким образом можно регулировать сроки схватывания цементного теста? 3.32. Как влияет температура на прочность изделий из глиноземистого цемента? Напишите уравнения процессов твердения этого цемента при различных температурах. 3.33. Какое природное сырье используется для получения гидравлической извести? Чем оно отличается от сырья, идущего на производство воздушной извести? Что общего и чем отличается по химическому составу воздушная и гидравлическая известь? 3.34. Что называется портландцементным клинкером и как он получается? В чем отличие цемента от клинкера? Какой минерал является основным в составе клинкера? Как он взаимодействует с водой? 3.35. Какова роль добавки аморфного кремнезема (SiO2) к портландцементу? Устойчивость пуццоланового цемента в агрессивных средах. 3.36. С какой целью в глиноземистый цемент рекомендуется вводить гипс, если твердение раствора будет происходить при температуре выше 30°С? 3.37. В чем заключается процесс схватывания и твердения портландцемента? Физико-химические основы процесса твердения. 3.38. Минералогический состав цементного камня. Какой из минералов цементного камня характеризуется самой высокой растворимостью в воде? 3.39. Отличие пластифицированного и гидрофобного портландцемента от обычного портландцемента? Отличие быстротвердеющего портландцемента и шлакопортландцемента от обычных портландцемента и шлакопортландцемента? 3.40. Какие добавки применяют в портландцементе при помоле клинкера? Что такое пуццолановый портландцемент и с какими гидравлическими добавками его изготовляют? 3.41. Рассчитать, в каком соотношении следует смешивать портландцемент и гидравлическую добавку, содержащую 25% активного кремнезема, чтобы кремнезем соединился со свободной известью (выделяемой цементом при твердении) и образовался однокальциевый гидросиликат. Содержание трехкальциевого силиката в портландцементе составляет 50%. 3.42. Рассчитать, сколько свободной Ca(OH)2 выделится при гидратации 10 кг портландцемента, содержащего 60% С3S, если алит полностью гидратируется? 3.43. Сколько тонн каустического магнезита можно получить при обжиге 10 т магнезита, содержащего 12% (по массе) неразрушающихся примесей? 3.44. Сколько активной MgO будет содержаться в продукте обжига 20 т чистого доломита при 500°С? Диссоциацией CaCO3 при этой температуре можно пренебречь. 3.45. Рассчитать, сколько MgCl2×6H2O необходимо для затворения 20 кг MgO, если известно, что в процессе твердения 70% магнезита гидратируется до Mg(OH)2 и 30% магнезита расходуется на образование оксихлорида магния. 3.46. Сколько нужно взять каустического доломита вместо 1 кг каустического магнезита, чтобы получить вяжущее вещество одинаковой активности? Каустический доломит содержит 8% примесей по массе. 3.47. Определить содержание химически связанной воды при гидратации 3СaO×Al2O3. 3.48. Цемент, не содержащий добавок (кроме гипса), характеризуется минералогическим составом клинкера: С3S–48%; C2S–44%; C3A–4%; C4AF– 11%. Можно ли этот цемент считать сульфатостойким? 3.49. Определить содержание химически связанной воды при гидратации белита. Условно принять, что в результате реакции образуется 2СaO×SiO2×4H2O. 3.50. Определить содержание химически связанной воды для цементного камня, приготовленного из портландцемента, имеющего минералогический состав: С3S – 50%, C2S – 25%, С3А – 5%, C4AF – 18%. Указать конечные продукты клинкерных минералов. 3.51. Какое количество мылонафта III сорта (гидрофобная добавка), гипса, трепела и клинкера потребуется для получения 10 т гидрофобного портландцемента. Установлено, что при помоле нужно вводить в мельницу 0,15% мылонафта от веса клинкера, 5% двуводного гипса и 10% трепела. 3.52. Сколько нужно взять каустического доломита вместо 1 кг каустического магнезита, чтобы получить вяжущее вещество одинаковой активности. Каустический доломит содержит 8% примесей по массе. 3.53. При гидратации и гидролизе трехкальциевого силиката (минерала цементного клинкера) образуются двухкальциевый гидросиликат и гидроксид кальция. Написать уравнение реакции и рассчитать, какое количество Cа(ОН)2 образуется из 22,8 г 3СаО·SiO2. 3.54. Сколько (м3) песка (ρ = 1,40 кг/дм3) надо смешать с гашеной известью, полученной из известняка массой 20 т с массовой долей карбоната кальция, равной 94,6 %, для приготовления тощего известкового строительного раствора в соотношении 1:5 (чего к чему?) перед затворением этой смеси водой. Зачем в известь добавляют песок? 3.55. Сколько тепла выделяется при гашении 5 кг извести, содержащей 80% активной CaO, если каждый кг/моль CaO выделяет при гашении 65,1 кДж тепла? 3.56. На приготовление известково-песчаного кладочного раствора израсходовано 150 кг гашеной извести. Написать уравнение твердения известкового раствора и рассчитать, сколько литров СО2 (н. у.) пошло на карбонизацию 100 кг гашеной извести. 3.57. Для связывания растворимых солей (сульфатов) в глине, в керамическую шихту вводится карбонат бария. Написать уравнение реакции взаимодействия сульфата натрия с ВаСО3, рассчитать какое его количество, необходимо для нейтрализации 142 г Na2SO4, содержащегося в глиномассе. 3.58. Кальцит разлагается при нагревании на оксид кальция и оксид углерода (IV). Какая масса кальцита, содержащего 90 % мас. карбоната кальция, потребуется для получения 7,0 т негашеной извести? 3.59. Хлорид бария вводится в глиномассу для связывания растворимых сульфатов. Найти формулу кристаллогидрата хлорида бария, зная, что 36,6 г хлорида при прокаливании теряет в массе 5,4 г. 3.60. Антрацит используется при обжиге глиняного кирпича. Установлено, что при сжигании 3 г антрацита выделяется 5,3 л СО2, измеренного при н. у. Сколько процентов углерода (по массе) содержит антрацит? 3.61. Какое количество (т) известняка, содержащего примеси (3,85%), потребуется для получения огнеупорного высокоглиноземистого цемента массой 25 т, минеральный состав которого соответствует формуле CaO∙2Al2O3 (получают высокотемпературным обжигом смеси чистого оксида алюминия с известняком). 3.62. Сколько гашеной извести (в процентах к использованному известняку) можно получить из известняка, содержащего 2 % мас. примесей? 3.63. Оконное стекло содержит 13,0 % мас. оксида натрия, 13,7 % мас. оксида кальция и 73,3 % мас. оксида кремния. Определить молекулярный состав такого стекла. 3.64. Сколько кг негашеной извести получится при прокаливании 1 т известняка, содержащего 20 % мас. примесей? 3.65. Определить, сколько получится негашеной и гидратной извести из 50 т известняка, если естественная влажность известняка составляет 5 %, а содержание в нем CaO – 85 %. 3.66. При обжиге 100 кг известняка выделилось 18 м3 оксида углерода (IV). Сколько примесей, % мас., содержится в исходном материале (н. у.)? 3.67. Определить массы SiO2 и соды, которые потребуются для получения 1 кг растворимого стекла, состоящего только из метасиликата натрия. 3.68. Определить массовые доли оксидов (%), составляющих оконное стекло, Na2O·CaO·6SiO2. 3.69. Сколько негашеной извести получится при прокаливании 100 кг известняка, содержащего 15 % мас. примесей? 3.70. Сколько полуводного гипса получится после термической обработки 25 т гипсового камня? 3.71. Рассчитать сколько получится негашеной и гидратной извести из 32 т известняка с содержанием СаО - 85% и естественной влажностью 8%. 3.72. Сколько получится известкового теста, содержащего 50% воды, из 2 т извести-кипелки, имеющей активность 85%? 3.73. Определить выход сухой извести-кипелки из 22 т известняка содержащего 6,7% глинистых примесей. 3.74. Производится обжиг 300 т известняка, имеющего влажность 9 %, содержание глинистых примесей б % и песчаных примесей 4%. Каковы масса и сорт получаемой комовой извести? 3.75. Сколько можно получить гидроксида кальция (пушонки) с влажностью 5 % при гашении 35 т негашеной извести с активностью 80 %? 3.76. Сколько полуводного гипса можно получить после термической обработки 150 т гипсового камня, содержащего 6,7% примесей? 3.77. Определить количество связанной воды при полной гидратации 1 т полуводного гипса. 3.78. Сколько потребуется каменного угля с калорийностью 6300 ккал/кг, что бы получить 20 т негашеной извести из чистого известняка. Известно, что на разложение 1 моль известняка требуется 42,5 ккал. 3.79. Определить, какое количество полуводного гипса может получиться в результате термической обработки 50 т гипсового камня? 3.80. Образец клинкера портландцемента массой 100 г обработали с целью анализа крепкой соляной кислотой, в результате чего образовался AlCl3 массой 10,68 г и FeCl3 массой 6,50 г. Вычислить массовые доли алюминатной фазы С3А и целлита C4AF в образце клинкера по результатам анализа.
4 КОРРОЗИОННЫЕ ПРОЦЕССЫ В СТАЛЬНЫХ, БЕТОННЫХ И ЖЕЛЕЗОБЕТОННЫХ КОНСТРУКЦИЯХ. ЗАЩИТА ОТ КОРРОЗИИ 4.01. Классификация коррозионных процессов бетона, механизмы протекания. 4.02. Причины коррозии бетона. Основные виды коррозии. Методы защиты от коррозии. 4.03. Факторы, влияющие на интенсивность процесса коррозии бетонных и железобетонных конструкций. Способы замедления коррозии. 4.04. Морозостойкость бетонов. Гипотезы разрушения бетона при циклическом замораживании и оттаивании. Образование льда в порах бетона. 4.05. Виды коррозии цементного камня, их сущность. Наиболее опасный вид. 4.06. Коррозия 1 вида, предельная концентрация извести и растворимость минералов цементного камня. Факторы, определяющие скорость протекания коррозии 1 вида: присутствие посторонних ионов, плотность бетона, условия омывания. 4.07. Влияние карбонизации на стойкость бетона к коррозии 1 вида; другие последствия происходящих процессов. Стойкость различных цементов. Мероприятия по повышению стойкости бетона к коррозии 1 вида. 4.08. Коррозия 2 вида, ее сущность. Углекислотная коррозия, значение условий омывания. Действие других кислот, влияние растворимости продуктов коррозии на скорость разрушения цементного камня. Кислотоупорный цемент и бетон. 4.09. Действие магнезиальных солей. Действие щелочей на цементный камень и бетон, влияние минералогического состава цемента, роль заполнителей и добавок. 4.10. Коррозия 3 вида. Влияние концентрации сульфатных ионов и содержания С3А в цементе на интенсивность коррозии 3 вида. 4.11. Стойкость различных цементов к коррозии 3 вида. Сульфатостойкий цемент. Способы повышения сульфатостойкости бетона. 4.12. Коррозия бетона при взаимодействии щелочей цемента с кремнеземом заполнителя, ее особенности. Источники поступления щелочей в цемент. Способы предотвращения коррозии этого вида. 4.13. Механизм электрохимической коррозии арматуры в бетоне. Анодный и катодный процессы. Деполяризаторы. 4.14. Факторы, влияющие на интенсивность протекания коррозии арматуры в бетоне: плотность бетона, пассивирование, влажность бетона, наличие стимуляторов или замедлителей коррозии. 4.15. Механизм защитного действия бетона по отношению к стальной арматуре. 4.16. Сущность газовой коррозии бетона. Примеры. Методы защиты бетона от газовой коррозии. 4.17. Основные факторы, влияющие на состояние стальной арматуры в бетоне: снижение щелочности (газовая коррозия), плотность бетона и толщина защитного слоя, вид вяжущего и условия твердения добавки, ширина раскрытия трещин, электрокоррозия. 4.18. Защитные покрытия арматуры, для предотвращения ее коррозии. 4.19. Влияние жесткости воды на стабилизацию коррозии. 4.20. Биологическая коррозия бетона. Методы защиты бетона от биологической коррозии. 4.21. Какое количество гашеной извести, содержащей 80% Са(ОН)2, необходимо для устранения временной жесткости 1000 м3 воды, если в 1 л Н2О содержится 10 ммоль HCO3–? 4.22. Анализом воды найдено: содержание НСО3- – 126 мг/л, содержание свободной углекислоты в расчете на СО2 – 20 мг/л. Определить качество воды (агрессивная или стабильная/нестабильная) по отношению к бетону. 4.23. Как протекают электрохимические процессы коррозии луженого стального листа в слабощелочной среде (рН=8) при нарушении цельности покрытия? Укажите вид покрытия. Предложите другое покрытие для стального листа, с целью замедлить процесс коррозии при наступлении благоприятных условий ее протекания. 4.24. На титрование 0,4 л воды израсходовано 0,021 л 0,101 н. раствора HCl. Чему равна временная жесткость этой воды? 4.25. В исследуемой воде содержится 250,17 мг/л гидрокарбонатов. После контакта пробы воды с мрамором щелочность воды была 4,1 мг-экв/л. Стабильна ли вода? 4.26. Где при прочих равных условиях будет интенсивнее корродировать стальная и алюминиевая арматуры: во влажном бетоне (рН=12) или влажной земле (рН=5)? 4.27. Рассчитать основной показатель стабильности (Со), если гидрокарбонатов в исходной воде 231,8 мг/л, а щелочность воды после контакта с мрамором 4,5 мг-экв/л. Сделать вывод о стабильности воды. 4.28. Какое количество 70%-ной извести и соды Na2CO3 ∙ 10Н2О необходимо для умягчения 1 м3 воды? Если общая жесткость – 3,8 мг-экв/л, карбонатная – 2,4 мг-экв/л, свободная углекислота в расчете на СО2 3,8 мг-экв/л. 4.29. Приведите пример катодного покрытия на конструкционной стали (считать, что на железе) и анодного на титане. Запишите анодные и катодные реакции при электрохимической коррозии в обоих случаях при повреждении покрытий – для первого случая во влажной среде при рН=10, для второго – во влажной среде при рН=4. 4.30. На титрование 25,00 мл воды израсходовали 3,67 мл 0,01000 М раствора ЭДТА (Трилона Б). Рассчитать общую жесткость воды в мг-экв/л. 4.31. Анализом воды найдено: содержание НСО3– – 3,8 мг/л, содержание свободной углекислоты в расчете на СО2 – 23 мг/л. Определить качество воды (агрессивная или стабильная/нестабильная) по отношению к бетону. 4.32. Составьте схему протекторной защиты от коррозии стальной конструкции. Напишите уравнения реакций, протекающих в этом случае, если среда явно кислая (рН=3). 4.33. Стабильна ли вода, если основной показатель стабильности равен: Со1 = 1,5; Со2 = 1,0; Со3 = 0,6; а индекс стабильности: I1 = 1,4; I2 = 0; I3 = - 0,7? Введением каких реагентов корректируют нестабильную и агрессивную воду? 4.34. Карбонатная жесткость исходной воды 3,8 мг-экв/л. Определить концентрацию NaНСО3 (в мг/л) после умягчения воды на Na-катионитовом фильтре. 4.35. Как записать процессы, происходящие при коррозии изделия из конструкционной стали во влажной среде, где рН=8? Какие фазы стали являются катодом, а какие – анодом? 4.36. Щелочность исходной воды равна 5,2 мг-экв/л. Равновесное содержание гидрокарбонатов – 244 мг/л. Рассчитать основной показатель стабильности (Со). Указать реагенты для корректировки воды. 4.37. Определите необходимую дозу СаО в мг/л для обработки воды со следующими данными: карбонатная жесткость – 45 мг-экв/л; свободная углекислота в расчете на СО2 – 15 мг/л; активного продукта в извести – 60%. 4.38. Анализом воды найдено: содержание НСО3- – 244 мг/л, содержание свободной углекислоты в расчете на СО2 – 28 мг/л. Определить качество воды (агрессивная или стабильная/нестабильная) по отношению к бетону. 4.39. При монтаже стальной конструкции болтовыми соединениями, рабочий использовал медные шайбы. Инженер приказал разобрать конструкцию, почему? Ответ подтвердить соответствующими уравнениями реакций. 4.40. Вычислить количество 60%-ной извести, необходимое для умягчения 500 м3 воды, с исходной карбонатной жесткостью 3,8 мг-экв/л, свободной углекислоты в расчете на СО2 15,4 мг-экв/л.
5 ПОЛИМЕРНЫЕ СТРОИТЕЛЬНЫЕ МАТЕРИАЛЫ 5.01. Классификация полимеров по химическому составу, по величине молекулярной массы, по происхождению, по строению основной цепи. 5.02. Классификация полимеров по химической природе основной цепи, по форме макромолекул, по способу получения, по отношению к нагреву. 5.03. Полимеризация. Гетеролитический и гомолитический разрыв валентных связей. Радикальная полимеризация. Механизм и стадии радикальной полимеризации. Инициаторы радикальной полимеризации. 5.04. Каталитическая полимеризация. Отличительные черты по сравнению с радикальной. Инициирование, рост макроионов, прекращение роста. 5.05. Поликонденсация. Особенности образования полимера. Классификация процессов поликонденсации. 5.06. Способность полимеров к кристаллизации (строение цепи, энергия межмолекулярного взаимодействия, гибкость цепи, плотность упаковки молекул). 5.07. Высокоэластическое состояние полимеров (термодинамика). Нижний предел молекулярной массы, необходимый для проявления высокоэластической деформации. 5.08. Вязкотекучее состояние полимеров. Кристаллические полимеры. Влияние ориентации на механические свойства полимеров. 5.09. Структура и основные свойства полимерных тел. Аморфные и кристаллические полимеры. Температура стеклования. Механизм кристаллизации. 5.10. Основные характеристики пенопласта (на основе новолачных фенолоформальдегидных полимеров), получение и области его применения. 5.11. Основные характеристики поливинилхлорида, получение и области его применения. 5.12. Основные характеристики полиамида, получение и области его применения. 5.13. Основные характеристики поликарбоната, получение и области его применения. 5.14. Основные характеристики полиметилметакрилата, получение и области его применения. 5.15. Основные характеристики полиуретана, получение и области его применения. 5.16. Основные характеристики полиметилметакрилата, получение и области его применения. 5.17. Основные характеристики полипропилена, получение и области его применения. 5.18. Основные характеристики полиэтилена, получение и области его применения. 5.19. Основные характеристики полиэтилентерефталата, получение и области его применения. 5.20. Использование полимеров в строительстве на примере полимербетонов и полимерцементных бетонов.
6 МЕТОДЫ ИССЛЕДОВАНИЯ СТРОИТЕЛЬНЫХ МАТЕРИАЛОВ 6.01. Дайте классификацию физико-химических методов исследований строительных материалов. На каких явлениях они основаны? 6.02. Химический анализ. Общая схема аналитического определения. Классификация количественных химических анализов по массе, по свойству определяемого вещества. 6.03. Законы поглощения света. Закон Ламберта–Бугера–Бера. Фотоколориметрия. Методы фотоколориметрии: сущность, достоинства, предел обнаружения, применение для анализа силикатных материалов. 6.04. Титриметрический анализ. Сущность анализа, предел обнаружения, достоинства. Основные понятия: аналитическая реакция, титрант, точка эквивалентности, конечная точка титрования. Способы выражения состава раствора в титриметрии. Правило эквивалентности. Аналитическая реакция. Требования к аналитической реакции. 6.05. Классификация титриметрических методов по типу аналитической реакции. Приемы титрования: прямое, обратное. Принцип эквивалентности. Расчёт массы определяемого вещества. Кислотно–основное титрование. Сущность метода. Аналитическая реакция кислотно–основного титрования. Индикаторы. Применение метода для анализа силикатных материалов. 6.06. Окислительно–восстановительное титрование. Сущность метода. Титранты. Аналитическая реакция. Применение метода для анализа силикатных материалов. 6.07. Комплексонометрическое титрование. Сущность метода. Титранты. Аналитическая реакция. Индикаторы. Применение метода для анализа строительных материалов. 6.08. Гравиметрический анализ. Сущность, предел обнаружения, достоинства. Основные понятия и определения. Классификация гравиметрических методов. Метод выделения, метод отгонки. Сущность, предел обнаружения, достоинства. Применение для анализа строительных материалов. 6.09. Метод осаждения. Сущность, предел обнаружения, достоинства. Схема анализа. Осадитель, осаждаемая форма. Основные требования к форме осаждения. Определение объема осадителя. 6.10. Хроматография. Сущность, предел обнаружения, достоинства метода. Классификация хроматографических методов по агрегатному состоянию фаз. Основные понятия: сорбция, сорбент, порядок сорбции, энергия сорбции. 6.11. Основные положения газовой хроматографии. Хроматографирование. Хроматограмма. Хроматографические параметры: время удерживания. Определение количественного состава по хроматограмме. 6.12. Ионообменная хроматография. Сущность метода. Катиониты. Аниониты. Реакции ионного обмена. Определение содержания гипса в цементе методом ионообменной хроматографии. 6.13. Рентгенофазовый анализ. Природа и свойства рентгеновских лучей. Сущность метода. Применение для анализа строительных материалов. Основные понятия: элементарная ячейка, сингония кристалла, межплоскостное расстояние. Угол скольжения, порядок отражения РТГ лучей. Уравнение дифракции. Предел обнаружения, применение метода для анализа силикатных материалов. 6.14. Термический анализ. Сущность, предел обнаружения, возможности. Анализ гетерогенного химического процесса. Термограмма. Метод ДТА. Экзо– и эндотермические химические процессы. Определение термической устойчивости минералов (кальцита, магнезита). 6.15. Метод дифференциально-термического анализа (ДТА). Определение содержания химически связанной воды в цементном камне. Анализ известняков, доломитов. Анализ продуктов гидратации С2S, С3S, С4AF, С3A, СaSO4·0,5H2O. 6.16. Определение содержания гипса в цементе методом кислотно-основного титрования. 6.17. Определение суммарного содержания активных CaO и MgO в известняке, доломите методом кислотно-основного титрования. 6.18. Определение гигроскопической влаги в цементе и гипсе гравиметрическим методом. 6.19. Определение ангидрита в цементе и гипсе гравиметрическим методом. 6.20. Определение содержания Fe2O3 фотоколориметрическим методом. 6.21. На титрирование 1,1 г извести-кипелки израсходовано 35,3 мл 1 н. HCl. К какому сорту относится известь по содержанию активных CaO и MgО. 6.22. Негашеная известь содержит 78 % активных CaO и MgО. Сколько мл 1 н. HCl будет израсходовано на титрование 1,5 г этой извести? 6.23. К 50 мл раствора хлорида кальция прибавили избыток раствора карбоната натрия. Выделившийся осадок отфильтровали, высушили и прокалили. Масса полученного остатка составила 1,4 г. Определите массовую долю хлорида кальция в исходном растворе. 6.24. Из навески цемента массой 2 г весь магний был переведен в осадок Mg(OH)2, масса которого после прокаливания составила 0,06 г. Напишите уравнения соответствующих реакций и определите массовую долю магния в данном образце цемента в пересчете на оксид. 6.25. Какая масса 10%-ного раствора соляной кислоты потребуется для растворения 3,68 г доломита CaCO3·MgCO3? 6.26. Сколько граммов составят потери при прокаливании 46 г доломита CaCO3·MgCO3 до полного удаления углекислого газа? 6.27. При действии на 8 г доломита CaCO3·MgCO3 избытка кислоты дали 3,8 г углекислого газа. Каково содержание (в процентах) кальция в этом образце доломита? 6.28. На титрование 25,00 мл воды израсходовали 4,25 мл 0,01000 М раствора ЭДТА. Рассчитать общую жесткость воды в моль-экв/л. 6.29. На титрование 0,4 л воды израсходовано 0,021 л 0,10100 н. раствора HCl. Чему равна временная жесткость этой воды? 6.30. Смесь карбоната и гидрокарбоната натрия массой 146 г нагревали до тех пор, пока не прекратилось уменьшение массы. Масса остатка после нагревания составила 137г. Какова массовая доля карбоната натрия в исходной смеси? 6.31. Навеска известняка массой 0,1585 г растворена в кислоте и обработана избытком щавелевой кислоты. Выделенный при рН=9 осадок отфильтровали, промыли, растворили в серной кислоте и на титрование полученного раствора израсходовали 28,75 мл раствора перманганата калия с Т(KMnO4) = 0,002850 г/мл. Рассчитать массовую долю CaCO3 в известняке. 6.32. Из навески образца массой 0,5340 г после соответствующей обработки получено 0,2345 г CaO и 0,0235 г MgO. Рассчитать массовую долю CaCO3 и MgCO3 в образце. 6.33. Рассчитать массовую долю CaCO3 и MgCO3 в известняке, если после растворения 1,000 г пробы и соответствующей обработки, объем раствора довели до 100,0 мл и на титрование 20,00 мл полученного раствора для определения суммы Ca и Mg затратили 19,25 мл 0,05140 М раствора ЭДТА, а на титрование такого же аликвота для определения Mg израсходовали 6,26 мл того же раствора ЭДТА. 6.34. Рассчитать массовую долю оксида кальция в извеcтняке, если на титрование навески массой 0,8500 г израсходовали 20,00 мл раствора хлороводородной кислоты с титром равным 0,003650 г/мл. 6.35. Какую навеску силиката, содержащего около 20 % Al2O3, следует взять для анализа, чтобы после сплавления и соответствующей обработки пробы, алюминий был отделен и оттитрован 10 мл 0,1 н. раствора ЭДТА. Рассчитать относительную погрешность взвешивания навески на аналитических весах. 6.36. На титрование 25,00 мл воды израсходовали 4,08 мл 0,01000 М раствора ЭДТА. Рассчитать общую жесткость воды в моль-экв/л и относительную погрешность измерения объема титранта при абсолютной погрешности измерения объема ±0,02 мл. 6.37. Выразите гравиметрические факторы при определении Са, если в качестве гравиметрической формы использованы следующие соединения: CaO, CaSO4, СаСО3, СаС2О4. 6.38. Какие навески известняка надо взять для определения кальция в виде моногидрата оксалата кальция с использованием в качестве гравиметрической формы: а) оксид кальция; б) сульфат кальция? 6.39. При каком рН достигается практически полное осаждение ионов Са2+ в виде СаС2О4 из раствора, содержащего 0,005 моль/л ионов кальция, при 50% избытке осадителя и общем объеме раствора 100 мл? 6.40. При анализе цемента (навеска 1,5000 г) магний был осажден в виде гидроксида. Полученный осадок прокален до постоянного веса, масса которого оказалась равной 0,0450 г. Определить содержание магния (в виде оксида) в данном образце цемента.
| |