| Общая информация » Каталог студенческих работ » ЕСТЕСТВЕННЫЕ ДИСЦИПЛИНЫ » ПНИПУ, химия (контрольная работа, г.Чайковский) |
| 27.09.2014, 17:41 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Задание: 1. Написать выражение скорости химической реакции по закону действующих масс. 2. Определить, как изменится скорость реакции, если концентрацию реагентов увеличить в (А) раз, объем реакционной смеси увеличить в (Б) раз. 3. Определить направление протекания реакции, при изменении температуры и давления (В). Пояснить на основании принципа Ле-Шателье. Таблица 5.
Задачи: 121. На сколько градусов надо повысить температуру в реакционной смеси, чтобы скорость реакции увеличилась в 81 раз. Температурный коэффициент равен 3. 122. Скорость реакции при 0С0 равна 0,1 моль/л·с. Вычислить скорость этой реакции при 30 С0, если температурный коэффициент равен 2. 123. При температуре 20 С0 реакция протекает за 2 мин. За сколько времени будет протекать эта же реакция при 50 С0, если температурный коэффициент равен 2. 124. При увеличении температуры на 30 С0 скорость реакции увеличивается в 9 раз. Как изменится скорость этой реакции при повышении температуры на 40 С0. 125. При ... реакция заканчивается за 16 мин. За какое время закончится эта реакция при 200 С0, если температурный коэффициент равен 2. 126. При 30 С0 реакция протекает за 25 мин, при 50 С0 реакция протекает за 4мин. Рассчитайте температурный коэффициент скорости реакции. 127. При температуре 20 С0 реакция протекает за 2 мин. За сколько времени будет протекать эта же реакция при 0 С0, если температурный коэффициент равен 2 128. На сколько градусов надо снизить температуру в реакционной смеси, чтобы скорость реакции уменьшилась в 27 раз. Температурный коэффициент равен 3. 129. При увеличении температуры реакционной смеси на ... скорость реакции увеличивается в 4 раза. Во сколько раз увеличится скорость при повышении температуры от 40 С0 до 70 С0? 130. При увеличении температуры на 20 С0 скорость реакции увеличилась в 6 раз. Как изменится скорость реакции при увеличении температуры от 20 С0 до 80 С0? 131. Реакция при 50 С0 протекает за 2 мин 15с. За какое время закончится эта реакция при 70 С0, если температурный коэффициент равен 3. 132. При 400 С0реакция протекает за 40 мин. Через сколько минут закончится эта реакция при 350 С0, если температурный коэффициент равен 2. 133. При увеличении температуры на 60 С0 скорость реакции увеличилась в 64 раза. Чему равен температурный коэффициент. 134. Во сколько раз уменьшиться скорость реакции, если температуру газовой смеси понизить от 140 С0 до 100 С0, если температурный коэффициент равен 3. 135. Во сколько раз и как изменится скорость реакции при снижении температуры от 40 С0 до 10 С0, если температурный коэффициент равен 3. 136. Чему равен температурный коэффициент реакции, если при увеличении температуры на 50 С0 скорость реакции увеличилась в 32 раза. 137. Скорость химической реакции при 20 С0 равна 2 моль/л. Вычислить скорость реакции при 60 С0, если температурный коэффициент равен 3. 138. На сколько градусов необходимо увеличить температуру реакции, чтобы её скорость увеличилась в 729 раз? Температурный коэффициент равен 3. 139. При увеличении температуры на 50 С0 скорость реакции увеличилась в 1024 раз. Вычислить температурный коэффициент. 140. На сколько градусов надо понизить температуру реакционной смеси для уменьшения скорости реакции в 27 раз, если температурный коэффициент равен 3. 141. Скорость некоторой реакции увеличивается в 3 раза при повышении температуры на 10С0. Во сколько раз увеличивается скорость при повышении температуры от 30 С0 до 80 С0. 142. Как изменится скорость реакции при повышении температуры от 25 С0 до 85 С0, если температурный коэффициент реакции равен 2. 143. Скорость реакции возросла в 124 раза. На сколько градусов была повышена температура, если температурный коэффициент скорости реакции равен 2,8? 144. При повышении температуры на 50 С0 скорость реакции возросла в 1200 раз. Вычислить температурный коэффициент. 145. Во сколько раз вырастет скорость реакции с повышением температуры от 40 С0 до 70 С0, если известно, что повышение температуры на каждые ... увеличивает скорость реакции в3 раза? 146. На сколько градусов следует повысить температуру, чтобы скорость реакции возросла в 8 раз, если температурный коэффициент равен 2. 147. Во сколько раз увеличится скорость реакции, если температура повысилась на 300С, температурный коэффициент равен 3. 148. При повышении температуры на 60 С0 скорость реакции увеличилась в 4 000 раз. Вычислить температурный коэффициент. 149. При 80 0С реакция заканчивается за 20 сек. Вычислите время протекания реакции при 30 0С, если температурный коэффициент этой реакции равен 2,5. 150. Вычислите, при какой температуре реакция закончится за 45 минут, если при 293К на это требуется 3 часа. Температурный коэффициент скорости реакции равен 3,2. 151. Для реакции 2NO2↔2NO+O2 вычислить константу равновесия и начальную концентрацию NO2, если равновесные концентрации равны [NO2]=0,006 моль/л; [NO]=0,024моль/л. 152. Для реакции 4NH3 +3O2↔2N2 + 6H2O. Вычислить константу равновесия; равновесную концентрацию [N2] и начальные концентрации реагентов, если [NH3]=0,37моль/л; [O2]=1,74моль/л; [H2O]=3,78моль/л. 153. Для реакции COCl2↔CO + Cl2. Вычислить константу равновесия и начальную концентрацию COCl2, если [COCl2]=4,65·10-5моль/л; [CO]=[Cl2]= 0,001моль/л. 154. Для реакции 4NO+6H2O↔4NH3+5O2 вычислить начальные концентрации и равновесную концентрацию [NH3], если [NO]=2,44моль/л; [H2O]=1,58моль/л; [O2]=0,65 моль/л. 155. Для реакции 2NO2↔2NO+O2 вычислить константу равновесия и С0(NO2) если [NO2]=0,02моль/л; [NO]=0,08моль/л; [O2]=0,16 моль/л. 156. Для реакции 4NH3 +3O2↔2N2 + 6H2O. Вычислить константу равновесия; равновесную концентрацию [N2] и начальные концентрации реагентов, если [NH3]=2,44 моль/л; [O2]=0,59 моль/л; [H2O]=8,22 моль/л. 157. Для реакции 4NO+6H2O↔4NH3+5O2 Вычислить начальные концентрации реагентов и равновесную концентрацию [NH3], если [NO]=3,86 моль/л; [H2O]=2,47моль/л; [O2]=1,35 моль/л. 158. Для реакции CO2+Н2↔CO+H2O вычислить константу равновесия и начальные концентрации исходных веществ, если [CO2]=0,02моль/л; [H2]=0,005моль/л; [CO]=0,015моль/л; [H2O]=0,015моль/л. 159. Для реакции SO3+CO↔SO2+CO2 рассчитать равновесные концентрации веществ, если Кр =1,89; С0(CO)=0,95моль/л. 160. Для реакции N2 + 3H2↔2NH3. Вычислить Кр и исходные концентрации реагентов, если [NH3]=0,4моль/л; [N2] =0,03моль/л; [Н2] =0,1моль/л. 161. Для реакции 2NF3+3H2↔6HF+N2 вычислить [HF] и первоначальные концентрации реагентов, если [NF3]=0,86моль/л; [Н2] =0,43моль/л; [N2] =1,24моль/л. 162. Для реакции H2+ SO3↔H2O+SO2. Рассчитать равновесные концентрации веществ, если Кр=1,36; С0(H2)=С0(SO3)=0,65моль/л. 163. Для реакции 4NH3 +3O2↔2N2 + 6H2O. Вычислить константу равновесия; равновесную концентрацию [N2] и начальные концентрации реагентов, если [NH3]=1,63моль/л; [O2]=2,15моль/л; [H2O]=7,44моль/л. 164. Для реакции 2NO+Cl2↔2NOCl вычислить константу равновесия, если С0(NO)=0,5моль/л; С0(Cl2)=0,2моль/л; а к моменту равновесия прореагировало 20% NO. 165. Для реакции 2NF3+3H2↔6HF+N2 вычислить [HF] и первоначальные концентрации реагентов, если [NF3]=1,15моль/л; [Н2] =0,72моль/л; [N2] =0,97моль/л. 166. Для реакции CO+Н2О↔ CO2+H2 вычислить равновесные концентрации веществ, если Кр=2,25; С0(CO)=С0(Н2О)=0,75моль/л. 167. Для реакции ... вычислить... и ..., если ...; ... ... 168. Для реакции .... Определить ... и начальные концентрации реагентов, если ...;...;... 169. Для реакции ... вычислить... и начальные концентрации реагентов, если ............ 170. Для реакции ... рассчитать равновесные концентрации веществ, если ..., .... 171. Для реакции ... вычислить ..., если ...; ...;... 172. Для реакции ... вычислить... и начальные концентрации реагентов, если ............ 173. Для реакции ... ..., .... Определить ... 174. Для реакции .... вычислить ... и начальные концентрации реагентов, если ...; ...;... 175. Для реакции ... вычислить равновесные концентрации веществ, если ...; ... 176. Для реакции ... ..., .... Определить ... 177. Рассчитать равновесные концентрации веществ для реакции ..., если ...; ...; ... 178. Для реакции ... вычислить ... и исходные концентрации веществ, если: ...; ...; ... 179. Рассчитайте равновесную концентрацию водорода в реакции 2НJ(г) = H2(г)+J2(г), если исходная концентрация НJ составляет 0,55 моль/л, а константа равновесия равна 0,12. 180. Равновесие гомогенной системы ...установилось при следующих концентрациях реагирующих веществ: [HCl] = 0,2 моль/л; [ O2] = 0,32 моль/л; [ Cl2] = 0,14 моль/л; [ Н2О] = 0,14 моль/л. Вычислите исходные концентрации кислорода и хлороводорода.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

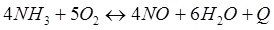
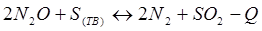
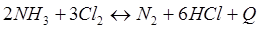
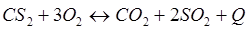
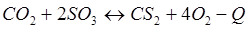
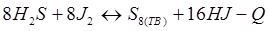
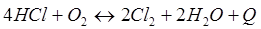
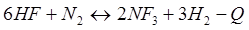
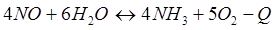
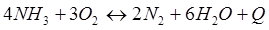
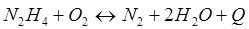
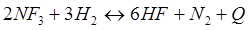
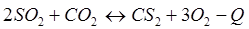
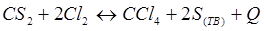
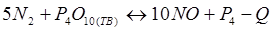
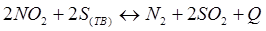
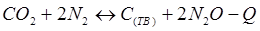
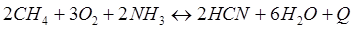
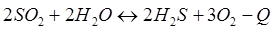
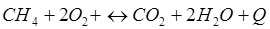
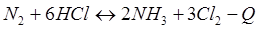
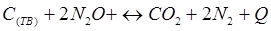
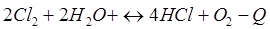
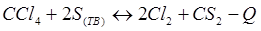
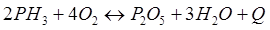
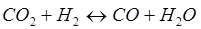 -Q
-Q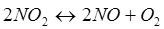 - Q
- Q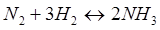 + Q
+ Q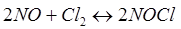 + Q
+ Q